- 化学反应原理
- 共2396题
17.某溶液中含有下列离子中的五种:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3–、CO32–、Cl–、NO3–、SO42–,浓度均为0.1mol/L。向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化。以下分析错误的是
正确答案
解析
从阳离子看,不可能共存的离子首先可以否定掉CO32–。若有HCO3–,则阳离子中能共存的只有Ba2+、Mg2+——此时阴离子只能是HCO3–、Cl–、NO3–,电荷不守恒,若阳离子只有Mg2+——此时阴离子只能是HCO3–、Cl–、NO3–、SO42–,仍是电荷不守恒,则HCO3–也不存在,故A.正确。D. 若原溶液中有三种阳离子,最小的电荷组合是3×2×0.1 mol/L,而两种阴离子的最大电荷组合是0.1mol/L+2×0.1mol/L,电荷不守恒,故D.错误。
考查方向
解题思路
从离子共存性质判断入手,辅之电荷守恒。
易错点
“向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化”信息判断失误,而不能确定是增加氯离子、还是原来就有氯离子。
知识点
8.下列实验中,所使用的装置(夹持装置略)、试剂和操作都正确的是
正确答案
解析
A.亚铁容易被氧化,需要考虑在制备氢氧化亚铁时避免与空气接触,因此在上层用植物油将空气与亚铁盐溶液隔离,且滴管伸入到液面以下也考虑滴加过程带入空气,故正确。
B.硝酸钠固体的溶解应该事先在烧杯中完成,存在实验操作上的不严谨和科学错误,故错误。
C.氨气的制备是使用铵盐与碱加热条件反应,且收集时应考虑氨气极易溶于水,故错误。
D.制备和探究乙烯的性质是,应该将温度计插入到液面以下,反应的条件是控制水浴温度,故错误。
考查方向
解题思路
实验题需要准确把握物质的基本性质、实验装置的安全性、仪器使用的正确性、条件控制的科学性
易错点
容量瓶的使用注意事项、氨气的收集以及氨气的物理性质、实验条件的控制
知识点
10.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
正确答案
B
解析
先加入稀硝酸,因其具有强氧化性,如果溶液中含有SO32-等也会形成BaSO4白色沉没,A错误。如果溶液中含有NH4+遇碱、加热会产生氨气,使湿润的红色石蕊试纸变红,B正确。两饱和溶液中的A-与 B- 的浓度不一定相同,无法判断水解程度的大小,C错误。蔗糖溶液水解得到的还原性糖与新制Cu(OH)2悬浊液的反应应当在碱性环境下进行,必须加入氢氧化钠中和多余的酸,D错误。
考查方向
解题思路
把握现象与结论之间的因果关系,加强重点实验的学习。
易错点
实验现象与结论之间的因果关系。
知识点
5.下面表格中的实验操作、实验现象和结论均正确且相符的是( )
正确答案
C
解析
浓硫酸滴到蔗糖表面,黑色固体膨胀,同时会有刺激性气味的气体生成,体现了浓硫酸脱水性和强氧化性,A项错误;
比较非金属性强弱关系,可通过最高价含氧酸的酸性强弱,而不能通过比较氢化物的酸性,B项错误;
向某溶液中加入浓NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则说明原溶液中含有NH4+,C项正确;
二氧化硫通入硫酸钡溶液中,亚硫酸电离出的氢离子和硝酸钡电离出的硝酸根离子构成了强氧化性的条件,可将亚硫酸根离子氧化成硫酸根离子,进而生成硫酸钡沉淀,D错误。
考查方向
解题思路
考虑问题要全面,不能忽视细节。
易错点
1、本题容易忽视浓硫酸的强氧化性。
2、本题不容易理解氢离子和硝酸根离子构成的强氧化性的条件。
知识点
5.甲、乙、丙三种物质有如右图转化关系:甲
正确答案
解析
四个答案中的化合物均能与氢氧化钠发生反应,化合价均未发生变化,因此都属于离子反应。A.Al2O3→AlO2-→AlCl3→(蒸发灼烧)Al2O3,故正确。
B.无法实现转化。C.CO2 →Na2CO3→NaHCO3→(加热或加盐酸)CO2 ,故正确。D.SiO2 →Na2SiO3→H2SiO3→(加热或加盐酸)SiO2 ,故正确。
考查方向
解题思路
准确把握各种元素的化合物性质,基本思路:单质→氧化物→酸(碱)→盐
易错点
元素各种形式相互转化条件
知识点
酸、碱性条件不同,产物亦可不同。以下对Na2SO3与AgNO3在不同的酸、碱性时反应进行探究,实验记录如下:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
18.Na2SO3溶液显 (填“酸”或“碱”)性。可用 (填序号字母)测定其酸碱性。
20. 同样方法证实三组实验中白色沉淀成分相同。分析a、b中现象不同的原因可能是 。
21.将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①可确定X中不含哪些物质或元素 。
② Ⅱ中反应的化学方程式是 。
22.综合以上实验,分析X产生的原因为随着溶液酸性的增强,体系还原性增强。通过进一步实验确认了这种可能性,实验如下:
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
正确答案
解析
Na2SO3为强碱弱酸盐,在溶液中水解显碱性,
解。
考查方向
解题思路
Na2SO3为强碱弱酸盐,水解显碱性,品红只用于检验SO2的漂白性,不用于酸碱性检验,而甲基橙的变色范围是3.1~4.4,无法肯定Na2SO3溶液一定是呈碱性,所以选择PH试纸和酚酞来测定Na2SO3溶液的酸碱性。
正确答案
① 4AgNO3+2 Na2SO3+O2=2Ag2SO4+4NaNO3 过量Na2SO3
解析
亚硫酸根离子具有还原性,氧气具有氧化性,溶液的pH=10,Na2SO3被氧气氧化,Na2SO3与AgNO3以及空气中的氧气反应:4AgNO3+2 Na2SO3+O2=2Ag2SO4+4NaNO3 。
设计实验确认白色沉淀是否为Ag2SO4,根据Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液分析,设计对照试验将Ag2SO4固体置于过量Na2SO3溶液中,未溶解。验证出沉淀为Ag2SO3
考查方向
解题思路
亚硫酸根离子具有还原性,氧气具有氧化性,Na2SO3与AgNO3以及空气中的氧气反应生成硫酸银;设计实验确认白色沉淀是否为Ag2SO4,根据Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液分析,设计对照试验;
正确答案
①不含 Ag2O及S元素(合理即可)
②Ag + 2HNO3(浓)== AgNO3 + NO2↑ + H2O
解析
①氧化银能和盐酸生成白色氯化银沉淀和水,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,
②向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X具有还原性,X只能为金属单质,只能为银,含有Ag元素,不含S元素。
故答案为:不含 Ag2O及S元素
③向X中加入过量浓HNO3,产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应方程式为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O;
考查方向
解题思路
①亚硫酸银能分解生成氧化银,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,因氧化银和盐酸生成白色氯化银沉淀和水;
②向X中加入过量浓HNO3,产生红棕色气体为NO2,说明为银和硝酸的反应,分析X是银;
③银和硝酸反应生成硝酸银、二氧化氮、水;
正确答案
① SO2 ② Ag2SO3 + H2O == 2Ag + H2SO4
解析
①海绵状棕黑色物质X为Ag,产生Ag的原因,可能为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化,实验确认,可通+4价硫的氧化物二氧化硫进行实验确认,通入二氧化硫后,瓶中白色沉淀Ag2SO3转化为棕黑色Ag,
故答案为:SO2;
②X为Ag,白色沉淀转化为X,为在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化生成银和硫酸,反应为:Ag2SO3+H2O=2Ag+H2SO4。故答案为:Ag2SO3+H2O=2Ag+H2SO4.
考查方向
解题思路
①溶液的酸性增强,+4价硫的还原性增强,能被+1价银氧化,+4价硫的氧化物为二氧化硫;
②酸性增强,+4价硫的亚硫酸银,被+1价银氧化生成银和硫酸。
易错点
中通入SO2气体的选择
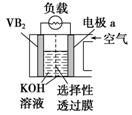
11.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为4VB2+11O2===4B2O3+2V2O5。下列说法正确的是
正确答案
解析
硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,所以X为正极,故A错误;B、原电池中,阴离子向负极移动,阳离子向正极移动,所以溶液中的OH-向另一极移动,故B错误;C、电子通过外电路由负极向正极移动,溶液中只有离子的移动。故C错误D、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O,故D正确.本题正确答案是D
考查方向
解题思路
A、根据原电池中负极失电子来判断;B、原电池溶液中阴离子向负极移动;C、电子通过外电路由负极向正极移动,D、负极上是VB2失电子发生氧化反应.
易错点
原电池的工作原理,电极反应式的判断。
知识点

正确答案
解析
A.正极发生还原反应,为Fe3++e-═Fe2+,故A错误;
B.左边烧杯中发生Fe3++e-═Fe2+,则左烧杯中溶液的红色逐渐变浅,故B正确;
C.阴离子向负极移动,故C错误;
D.若将甲烧杯中的溶液换成稀硝酸,可氧化铜,铜为负极,电流表指针偏转方向不变,故D错误.
故选B.
考查方向
原电池和电解池的工作原理
解题思路
该原电池反应为Cu+2FeCl3═2FeCl2+CuCl2,则负极为Cu,发生Cu-2e-=Cu2+,阳离子移动到正极,左边烧杯中发生Fe3++e-═Fe2+,以此来解答。
易错点
根据失电子难易程度确定正负极。
知识点
17.某溶液中只可能含有
正确答案
解析
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有气泡冒出,说明溶液中含离子CO32-或SO32-;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-,那么一定含有:CO32-,一定不能含有与碳酸根生成沉淀的离子:Al3+、Mg2+,通过以上分析,根据电中性原理,能证明K+存在,所以无法判断氢氧根离子的存在与否,可以取样,加入足量BaCl2溶液,再滴加紫色石蕊试液看是否变红来检验
考查方向
常见离子的检验
解题思路
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子CO32-或SO32-离子,那么与其混合生成沉淀的不能存在;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-,据此进行解答
易错点
用溶液的电中性判断含有K+
教师点评
本题考查离子的检验及离子共存问题,题目难度中等,注意掌握常见离子的性质及检验方法,明确常见离子的反应的现象,然后结合离子的性质进行判断
知识点
19.离子方程式Ba2+ + 2OH-+ 2H+ + SO42-→ BaSO4↓ + 2H2O可表示
正确答案
解析
A.Ba(OH)2与NaHSO4两溶液的溶质按物质的量之比2:1反应时的离子反应为Ba2++OH-+H++SO42-=BaSO4↓+H2O,故A不选;
B.Ba(OH)2与NaHSO4两溶液的溶质按物质的量之比1:2反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B选;
C.Ba(OH)2与NH4HSO4两溶液的溶质按物质的量之比2:1反应的离子反应为Ba2++2OH-+NH4++H++SO42-=BaSO4↓+H2O+NH3.H2O,故C不选;
D.Ba(OH)2与NH4HSO4两溶液的溶质按物质的量之比1:2反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D选
考查方向
离子方程式的书写
解题思路
Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O可表示氢氧化钡与硫酸(或硫酸的酸式盐)反应的离子反应,以此来解答
易错点
CD项中:OH-与H+、NH4+的反应顺序
教师点评
本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,注意量少的物质完全反应,题目难度不大
知识点
4.已知某种微生物燃料电池工作原理如图所示。下列有
关该电池的说法中,正确的是
正确答案
解析
根据图知,A电极上C元素化合价由0价变为+4价,则A是负极、B是正极,负极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,电解质溶液呈酸性,则正极反应式为O2+4e-+4H+=2H2O,
A.通过以上分析知,A是负极、B是正极,电子从A流向B,故A错误;
B.电池内电解质溶液中所含的H+由负极A移向正极B,故B错误;
C.B极为正极,正极反应式为O2+4e-+4H+=2H2O,正极上消耗氢离子,所以溶液pH增大,故C错误;
D.A电极上失电子发生氧化反应,则A极的电极反应为:CH3COOH-8e-+2H2O═2CO2↑+8H+,故D正确
考查方向
电化学
解题思路
根据图知,A电极上C元素化合价升高失电子,则A是负极、B是正极,负极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,电解质溶液呈酸性,则正极反应式为O2+4e-+4H+=2H2O,据此分析解答
易错点
B项:阴阳离子的移动方向
教师点评
本题考查了原电池原理的应用,题目难度不大,注意把握原电池反应中元素化合价的变化以及电极的判断和电极方程式的书写
知识点
下列关于山岭隧道施工技术的叙述,不正确的是( )。
A.山岭隧道的洞身开挖一般选择盾构法施工技术
B.岩石隧道的爆破应采用光面爆破或预裂爆破技术
C.山岭隧道的洞身选择支护方式时,应优先采用锚杆、喷射混凝土或锚喷联合作为临时支护
D.在软弱围岩中采用锚喷支护时,应根据地质条件采取合适的超前支护形式
正确答案
A
解析
暂无解析
室温下,将1.000mol·L-1盐酸滴入20.00mol,1000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示,下列有关说法正确的是
正确答案
解析
本题综合考查水溶液中的电离平衡以及酸碱中和滴定的相关知识。
a点7<pH<14,因此水电离出的
知识点
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是
正确答案
解析
略。
知识点
12.已知:常温下某浓度
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析