- 化学反应原理
- 共2396题
7.下列说法正确的是( )
正确答案
知识点
下列有关说法正确的是( )
正确答案
解析
铜比铁稳定,应附着比铁活泼的锌,A错误;反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的体积减小,若在常温下能自发进行,则该反应的△H<0;B 错误;水解是吸热反应,所以C正确;D选项速率增大,平衡常数减小,错误。
知识点
室温时,M(OH)2(S) 
正确答案
解析
考察沉淀溶解平衡与PH值的关系。C(M2+)·C2(OH-)= a ;C2(OH-)=a/b,经过计算。
知识点
实验:① 0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;
② 向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。
下列分析不正确的是
正确答案
解析
略
知识点
16. 室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是( )
正确答案
解析
略
知识点
25 ℃在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
正确答案
解析
①中pH=0的H2SO4中c(H+)=1.0 mol·L-1,c(OH-)=1.0×10-14mol·L-1,水电离程度为1.0×10-14mol·L-1。②中c(OH-)=0.1 mol·L-1,c(H+)=1.0×10-13mol·L-1,水电离程度为1.0×10-13mol·L-1。③中c(OH-)=1.0×10-4mol·L-1,水的电离程度为1.0×10-4mol·L-1。④中c(H+)=1.0×10-5mol·L-1,水的电离程度为1.0×10-5mol·L-1。故①②③④中水的电离程度之比为:1.0×10-14mol·L-1:1.0×10-13mol·L-1:1.0×10-4mol·L-1:1.0×10-5mol·L-1=1:10:1010:109,A项正确。
知识点
一定温度下,下列溶液的离子浓度关系式正确的是
正确答案
解析
略
知识点
常温下0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
正确答案
解析
醋酸是弱酸,稀释10倍,pH增加不到一个单位,A项错误,加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确。
加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误。提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
此题涉及弱电解质的电离平衡移动,切入点都是比较常规的设问,但学生易错选。
知识点
10.向10mL0.001mol·L-1NaOH溶液分别加入等体积的下列各溶液,所得溶液的pH最小的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.已知25℃时,
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. I.现有常温下甲、乙两种溶液。已知甲为


(1)溶液甲中离子浓度由大到小关系是( ) 。
(2)溶液乙中

(3)甲、乙溶液中阴离子的物质的量浓度之和的大小关系:溶液甲( )溶液乙。(填“<”、“>”、“=”)
II.在恒定电流的情况下,将含0.1 molNaCl和0.1molCuSO4的混合溶液500mL。进行电解,2min后阴极开始产生气体,5min时停止电解,此时两极产生的气体体积理论上相同。
(1)请在图中画出阴阳两极产生气体的体积(已换成标准状况下的体积)与时间的关系。
(2)电解结束时消耗水的质量为( )g;将溶液稀释为1000mL后,所得溶液的pH为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.常温下,下列关于溶液pH的计算错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.某温度下,向PH=6的纯水中加入一定量的盐酸,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5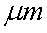
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
根据表中数据判断试样的pH=( )。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H20 (g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:( )。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是( ) 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=( ) 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 ( ) 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 ( ) 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,
2CO(g)=2C(s)+O2(g)
已知该反应的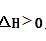
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析




















