- 化学反应原理
- 共2396题
7.下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
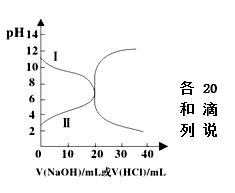
11.25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是( )。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 ( ) 。
Na2CO3可用于工业上制玻璃,涉及的化学反应方程式为 ( ) 。
等浓度等体积的Na2CO3与NaHCO3的混合溶液中,离子浓度的大小顺序为( )。
(3)某课外活动小组模拟上述制碱原理,进行碳酸氢钠的制备实验,同学们将二氧化碳气体通入含氨的饱和食盐水制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。试回答下列有关问题:
(Ⅰ)乙装置中的试剂是( ),该试剂的作用是( )。
(Ⅱ)实验结束后,分离出NaHCO3 晶体的操作是( )(填分离操作的名称),该操作所需要的玻璃仪器有( )。
正确答案
(1)c
(2)再滴加硝酸银溶液和过量稀硝酸,看是否有白色沉淀生成
(3)(Ⅰ)饱和碳酸氢钠溶液(1分);除去CO2中的HCl气体
(Ⅲ)过滤; 玻璃棒、漏斗、烧杯
解析
解析已在路上飞奔,马上就到!
知识点
11.下列各溶液中,粒子物质的量浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. 常温下,用 0.1000 mol L-1NaOH 溶液滴定 20.00 ml 0.1000 mol.L-1CH3COOH溶液,所得滴定曲线如下图所示。
请回答:
(1) 有人认为,C点时NaOH与CH3COOH恰好完全反应,这种看法是否正确______?(选填“是”或“否”),理由是________________________;
(2) 关于该滴定实验,从下列选项中选出最恰当的一项____ (选填字母);
(3) 在B点时,溶液中

(4) 在A〜D区间内,下列大小关系可能存在的是________;
①
②
③
④
(5) 若向该醋酸溶液中加入少量的醋酸钠晶体,则溶液的pH会____(选填“增大”、“减小”或“不变”);
(6) 常温下,用该NaOH溶液滴定25.00 mL—定浓度的某稀H2SO4溶液,达到滴定终点时消耗NaOH溶液的体积为25.00 mL,则该稀H2SO4溶液的pH=____。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.常温下,0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9。下列说法中不正确的()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.德国化工学家哈伯于1905发明的合成氨工业对化学工业和国防工业具有重要意义。
下图为合成氨工业生产的示意图。
(1)图中条件选定的主要原因是(填字母)( )
A.温度、催化剂对化学平衡的影响
B.铁触媒在该温度时活性最大
C.工业生产受动力材料、设备等条件的限制
(2)在一定温度下,有甲、乙容积相等的容器
(I)向甲容器中通入3molN2和3molH2,反应达到平衡时,生成NH3 amol。此时NH3的物质的量分数是( )。
(II)向乙中通入2molNH3,欲使反应达到平衡时,各物质的浓度与(I)中平衡时相同,则起始时还需通入( )molN2。
(III)若起始时向乙中通入6molN2和6molH2达到平衡时,生成的NH3的物质的量为( )bmol,则a:b ( )1:2。(填“>”、“<”或“=”)
(3)随着对合成氨研究的发展,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶簿膜做电极,实现了常压下高转化率的电解合成氨,装置如图所示。请回答:
该电解池中,钯电极B是电解池的( )极;则A电极上的电极反应式是( )。
(4)常温下,将pH = x的氨水和pH = y的盐酸(x、y均为正整数且x+y≥14)溶液等体积混合,某些同学分别认为混合液中的离子可能存在如下的关系,其中一定不正确的是( )(填序号)
① c(NH4+) > c(Cl—) > c(OH—) > c(H+)
② c(Cl—) > c(NH4+) > c(H+) > c(OH—)
③ c(NH4+) > c(OH—) > c(Cl—) > c(H+)
④ c(Cl—) = c(NH4+) > c(H+) = c(OH—)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.常温下,用0.1000 mol/L HCl溶液滴定 20.00 mL 0.1000 mol/L NH3•H2O溶液滴定曲线如右图。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.已知,常温下某浓度NaHSO3稀溶液的pH<7。则该稀溶液中下列粒子关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(I)可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),假设还原产物只有NO和NO2两种。其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL—50mL),乙管可上下移动。
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择( )(填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。
(3)要测定m值,需要将c中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须的进行操作是( ) 。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二:( )。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是 ( ) 。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L)。C中硝酸的物质的量为n mol,则用含n和V的式子表示m=( )。
II.下列框图中,A由两种黑色的金属氧化物等物质的量混合而成,B中含有四种阳离子,据此回答下列问题:
(1)A的组成是( )(填化学式)。
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱
的顺序依次是( ) 。
(3)电解所用装置如右图所示。
①电解开始阶段,阴极上的电极反应是( )。
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度
由大到小的顺序是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9、下列溶液中各微粒的浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列说法正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13. HA为酸性略强于醋酸的一元弱酸。在0.1 mol·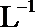
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。对于浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12、下列溶液中有关微粒的物质的量浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析