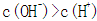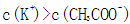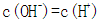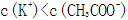- 化学反应原理
- 共2396题
下列说法正确的是
正确答案
解析
水的离子积常数只与温度有关,温度越高,Kw越大,A错;SO2通入碘水中被I2氧化生成SO42-,B错;加入铝粉能产生H2的溶液可能是强酸性溶液,也可能可能是强碱性溶液,在强酸性溶液中不可能存在AlO2―和NO3-(硝酸与铝反应不生成氢气),在强碱性溶液中,C中离子互不反应,可以大量共存,C正确;100℃时,Kw=1×10-12,所以pH=2的盐酸c(H+)= 0.01mol/L,pH=12的NaOH溶液的c(OH―)=1mol/L,等体积混合时碱过量,溶液显碱性,D错。
知识点
常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定错误的是
正确答案
解析
本题考查电解质溶液的知识,意在考查考生思维的缜密性。若a=b,恰好反应生成弱酸强碱盐CH3COOK,溶液呈碱性,A项正确;若a>b,反应后溶液中溶质为CH3COOK和CH3COOH,该溶液可能呈中性,则C项正确;若该溶液含CH3COOH很少,CH3COOH的电离程度小于CH3COO-的水解程度,溶液呈碱性,则溶液中c(K+)>c(CH3COO-),B项正确;若溶液中c(K+)<c(CH3COO-),利用电荷守恒知溶液中一定存在c(H+)>c(OH-),溶液显酸性,而a<b,溶液一定呈碱性,二者矛盾,D项一定错误。
知识点
下列叙述不正确的是( )
正确答案
解析
A项的命题意图是考查溶液电中性,但忽视了H2PO4-的存在,错误;B项中醋酸过量,混合后溶液呈酸性,正确;碱和酸均抑制水的电离,而可水解的盐则促进水的电离,C项正确;D项中因Ag+和氨水可形成络离子而使AgCl的溶解平衡右移,故AgCl在氨水中溶解度增大,正确。
知识点
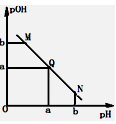
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则
正确答案
解析
由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错;N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),B错;由于M点的H+浓度等于N点的OH-浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,C正确;Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性。则所加NaOH溶液体积略小于醋酸溶液的体积,D错。
知识点
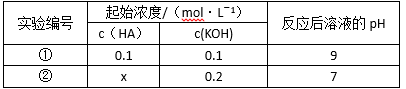
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是
正确答案
解析
由表中①的HA为弱酸且酸碱物质的量相等,因此得A正确;由①中电荷守恒得[OH-]=[K+]-[A-]+[H+]=Kw/1X10-9 mol/L,故B错误;C中由②得X>0.2mol/L,故C正确;由电荷守恒得D正确
知识点
对于常温下pH为2的盐酸,叙述正确的是
正确答案
解析
电荷守恒A对。B 氨水过量,显碱性。D,反应后生成乙酸和氯化钠,水溶液为酸性。
知识点
25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
正确答案
解析
pH为7,说明混合后的溶液显中性,根据溶液中的电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),可知c(Na+)=c(A-),故C正确。若HA为强酸,则a=b,若HA为弱酸,则应是a>b,现在不知是强酸还是弱酸,故无法确定a和b的关系。
知识点
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
下列判断不正确的是
正确答案
解析
略
知识点
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
正确答案
解析
a溶液分为四种情况①若酸为强酸,则反应后氨水有剩余,溶液呈碱性;②若酸为弱酸且酸的电离程度比氨水还弱,则溶液呈酸性;③若酸为弱酸且酸的电离程度比氨水强,则溶液呈碱性;④若酸为弱酸且酸的电离程度与氨水相同,则溶液呈中性。b溶液分为两种情况:①若酸为强酸,则二者恰好反应生成强酸强碱盐,溶液呈中性;②若酸为弱酸,则反应后酸有剩余,溶液呈酸性。
知识点
室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
正确答案
解析
略
知识点
在55℃时,下列说法正确的是
正确答案
解析
略
知识点
下列说法错误的是
正确答案
解析
略
知识点
在常温下,0.100 0 mol·L-1 Na2CO3溶液25 mL用0.100 0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
正确答案
解析
略
知识点
室温时,将浓度和体积分别为c1、V1的盐酸溶液和c2、V2的氨水溶液相混合,下列关于该混合溶液的叙述错误的是( )
正确答案
解析
略
知识点
有3种溶液
①0.01 mol•L—1醋酸;
②0.02 mol•L—1醋酸与0.02 mol•L—1NaOH等体积混合后的溶液;
③0.04 mol•L—1醋酸与0.02 mol•L—1 NaOH等体积混合后的溶液。
下列说法不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析