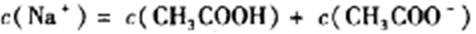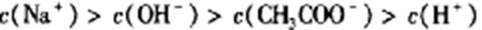- 化学反应原理
- 共2396题
常温下,取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
正确答案
解析
略
知识点
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
正确答案
解析
略
知识点
下列叙述正确的是
正确答案
解析
略
知识点
下列叙述正确的是
正确答案
解析
略
知识点
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
正确答案
解析
略
知识点
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后体积为混合前体积之和)。下列叙述错误的是
正确答案
解析
略。
知识点
13.某温度下,水的离子积常数
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液,滴定的曲线如右图,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30.阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入指示剂。
B、用待测定的溶液润洗酸式滴定管 C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—75px处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水 F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) _______ ;
②在G操作中如何确定终点? ________________________
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) _______ 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用______的NaOH溶液,原因是_____________ (5)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) ______ 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9. t℃ 时,水的离子积为Kw ,该温度下将 a mol/L 一元酸 HA 与b mol/L一元碱BOH 等体积混合,若混合后溶液呈中性,下列说法一定正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知温度T时,水的离子积常数为KW,该温度下将


正确答案
解析
解析已在路上飞奔,马上就到!
知识点
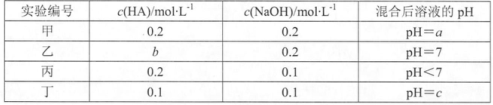
11.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
下列对混合后溶液的有关说法中,不正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.室温时,将O.1mol.L-1氨水和O.1mol.L-1盐酸等体积混合(忽略体积的变化),对所得溶液的说法不正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.常温时pH = 12的两种一元碱x和y,体积均为10 mL ,稀释过程中pH 与溶液体积的关系如图所示。分别加入0.1mol/L的HCl溶液至pH = 7,消耗HCl溶液的体积分
别为Vx和Vy,则( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.常温下,下列有关溶液叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析