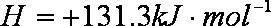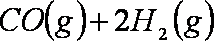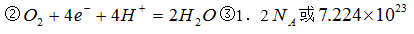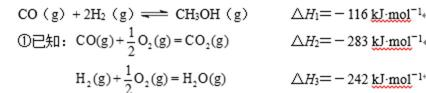- 化学反应原理
- 共2396题
11.由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
正确答案
BC
知识点
15.在0.2mol·L—1Cu(NO3)2和Fe(NO3)3溶液中,通入一定量H2S气体,下列不可能发生的离子方程式是
正确答案
解析
0.2mol·L—1Cu(NO3)2和Fe(NO3)3溶液中,根据盐类水解的特点,不难判断溶液呈酸性,因此存在强氧化剂三价铁离子以及硝酸根在酸性条件下的强氧化性,硫化氢中的硫元素处于低价,是较强的还原剂,因此当硫化氢通入到该混合溶液中一定能发生氧化还原反应,所以A,D正确。因为硫化铜不能溶解在酸性溶液中,因此能生成硫化铜难溶于水,不溶于一般稀酸.溶于热的稀硝酸,但是硫化亚铁能溶于酸性溶液。故B错误
考查方向
解题思路
抓住离子反应条件、常见氧化剂、还原剂、沉淀生成与溶解
易错点
氧化还原反应、离子反应条件
知识点
中国自古有“信口雌黄”、“雄黄入药”之说。雌黄

18.砷元素有+2、+3
①Ⅰ中,氧化剂是_________。
②Ⅱ中,若

19.Ⅲ中产物亚砷酸
①人体血液的pH在7.35 7.45之间,用药后人体中含砷元素的主要微粒是_________ 。
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是_________。
③下列说法正确的是_________(填字母序号)。
a. 
b. pH=12时,溶液
c.在
20.工业含砷(Ⅲ)废水常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中生产
结果⑵和⑶中图示解释可能的原因:
正确答案
As2S3 As4S4+7O2-----2As2O3+4SO2;
解析
① 该题考察了氧化还原的知识点,较为简单,I中反应,降价得电子的物质是As2S3,故为氧化剂; ②通过得失电子守恒法法配平,可得方程式As4S4+7O2-----2As2O3+4SO2;
考查方向
解题思路
As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根据方程式或化合价的变化判断;
易错点
对方程式中元素化学价计算不清
正确答案
① As2S3
② H3AsO3+OH------H2AsO3-+H2O
③ac
解析
① 可由图像得到,该段主要微粒为亚砷酸;
②调节至pH=11时,由图像可以得到离子反应式为H3AsO3+OH------H2AsO3-+H2O
③a选项可通过图像得到该点pH=9,显碱性;b选项pH=12溶液显碱性,氢氧根浓度必大于氢离子浓度;c选项可由图像得到;
考查方向
解题思路
反应中As和Sn元素化合价发生变化,根据化合价的变化判断氧化剂和还原剂等概念;
易错点
对方程式中元素化学价计算不清
正确答案
pH在5-9时,主要微粒为H3AsO3和H2AsO3-,由于Fe(OH)3胶粒表面带正电荷,可以
吸附负电荷微粒,随着pH上升,H2AsO3-含量变大,吸附效果变好。此外,pH升高
更利于水解,促进Fe(OH)3生成,Fe(OH)3含量升高,吸附效果变好。
解析
通过已知调节可以知道吸附性主要依靠Fe(OH)3的碱性和表面正电荷作用,由图(2)
可得到pH=5~9之间的溶液主要存在微粒为H3AsO3和H2AsO3-且随着pH增大,后者含量更多,则静电作用的吸附性更强;此外,pH升高更利于水解,促进Fe(OH)3生成,Fe(OH)3含量升高,吸附效果变好。
考查方向
解题思路
通过已知调节可以知道吸附性主要依靠Fe(OH)3的碱性和表面正电荷作用,由图(2)
可得到pH=5~9之间的溶液主要存在微粒为H3AsO3和H2AsO3-且随着pH增大,后者含量更多,则静电作用的吸附性更强;此外,pH升高更利于水解,促进Fe(OH)3生成,Fe(OH)3含量升高,吸附效果变好。
易错点
对方程式中元素化学价计算不清
8.为探究NaHCO3、Na2CO3与1 mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示。下列说法不正确的是( )
正确答案
解析
A.点③溶液中,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可知:c(Na+)
B.点①溶液的是等浓度的CH3COOH和CH3COONa,点②溶液的是等浓度的HCN和NaCN,HCN的电离平衡常数
C.点④溶液中是CH3COONa溶液,醋酸根离子水解,溶液显碱性,因此:c(Na+)>c(CH3COO–)>c(OH–)>c(H+),C正确;
D.在点②和③之间(不包括端点),c(CH3COO-)>c(CH3COOH),醋酸的电离平衡常数大于醋酸根离子的水解平衡常数,因此:c(CH3COO–)>c(Na+),溶液的pH<7,因此:c(H+)>c(OH–),综上所述,存在离子浓度大小关系:c(CH3COO–)>c(Na+)>c(H+)>c(OH–),D正确。
故选A。
考查方向
解题思路
A.点③溶液中,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可知:c(Na+)<c(CH3COO-)+c(CH3COOH),因此:c(OH–)<c(H+)+c(CH3COOH);
B.点①溶液的是等浓度的CH3COOH和CH3COONa,点②溶液的是等浓度的HCN和NaCN,HCN的电离平衡常数<CH3COOH,NaCN水解平衡常数>CH3COONa,因此:点①溶液的c(CN–)<点②溶液的c(CH3COO–);
C.点④溶液中是CH3COONa溶液,醋酸根离子水解,溶液显碱性,因此:c(Na+)>c(CH3COO–)>c(OH–)>c(H+);
D.在点②和③之间(不包括端点),c(CH3COO-)>c(CH3COOH),醋酸的电离平衡常数大于醋酸根离子的水解平衡常数,因此:c(CH3COO–)>c(Na+),溶液的pH<7,因此:c(H+)>c(OH–),综上所述,存在离子浓度大小关系:c(CH3COO–)>c(Na+)>c(H+)>c(OH–)。
易错点
本题考查了图象分析,酸碱反应定量关系和溶液酸碱性的理解应用,掌握基础是关键,题目难度中等。
知识点
5.已知293K时下列物质的溶度积(单位已省略)
下列说法正确的是
正确答案
解析
A. c(Cu2+) c(S2-)=8.5╳10-45; c(Cu2+)= c(S2-)≈9╳10-23 mol/L;
c(Fe2+) c(S2-)=6.3╳10-18; c(Fe2+)= c(S2-)≈2.5╳10-9 mol/L;
c2(Ag+) c(SO42-)=1.2╳10-5; c(Ag+)= 2c(SO42-)≈3.4╳10-2 mol/L;
B. FeS+Cu2+=CuS↓+Fe2+
C. 混合后,c(Ag+)= c(SO42-)=0.002mol/L,
c2(Ag+)c(SO42-)=8╳10-9<1.2╳10-5,因此不能形成沉淀。
D. Ag2S(s)≒2Ag+(aq)+S2-(aq),加入硫化钠后,S2-浓度增加,平衡向左移动,Ag+浓度减小。
考查方向
难溶化合物的溶度积常数
解题思路
A. 错误。相同温度下,相同温度下,Ag2SO4、FeS、CuS饱和溶液中:c(Cu2+)<c(Fe2+)<c(Ag+);
B. 错误。FeS难溶于水,不能拆开。正确的离子方程式为:FeS+Cu2+=CuS↓+Fe2+
C. 正确。由于混合后的溶液中SO42-浓度与Ag+浓度的平方乘积小于溶度积常数,因而不能形成沉淀。
D. 错误。根据硫化银的沉淀溶解平衡,当S2-浓度增大的时候,Ag+浓度则会相应减小。
易错点
不能正确地运用Ksp的计算公式;不能正确理解沉淀溶解平衡。
教师点评
本题考查的是难溶化合物的溶度积常数,在近几年的各省高考题中出现的频率较低,常与沉淀溶解平衡等知识点交汇命题。
知识点
反应A(g)+2B(g)→ C(g)+D(g)过程中的能量变化如图所示,有关叙述正确的是
正确答案
解析
略
知识点
某一化学反应在不同条件下的能量变化曲线如右图所示。下列说法正确的是()
正确答案
解析
略
知识点
27.科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和


(1)“气化炉”中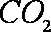
(2)用煤炭气合成甲醇的反应为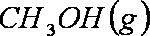
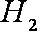
①生成甲醇的反应为__________反应(填“放热”或“吸热”)。
②若该反应在绝热、恒容的密闭体系中进行,下面3个图中,既正确又能说明反应在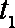
③在不改变原料用量的前提下,为提高CO的转化率,可以采取的措施是__________ (答一种措施即可)。
(3)近年来,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆,甲醇燃料电池的工作原理如下图所示。
①该电池工作时,b口通入的物质为__________,c口通入的物质为__________。
②该电池正极的电极反应式为__________。
③工作一段时间后,当6.4g甲醇完全反应生成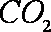
正确答案
(1)
(2)①放热 ; ②c; ③降低温度(或增大压强、分离出甲醇等)
(3)
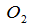
解析
解析已在路上飞奔,马上就到!
知识点
11.氯原子对O3分解有催化作用:Cl+O3=ClO+O2 ΔH1;ClO+O=Cl+O2 ΔH2大气臭氧层的分解反应是:O+O3=2O2 ΔH,该反应的能量变化示意图如下:下列叙述中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
SF6是一种优良的绝缘气体,分子结构中只存在S—F键,已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ.则S(s)+3F2(g)=SF6(g)的反应热ΔH为
正确答案
解析
本题考查化学热计算,化学反应的实质是旧键的断裂和新键的生成,旧键的断裂吸收热量,新键的生成放出热量,两个热量变化的总体效应即为反应的热效应,S(s)+3F2(g)===SF6(g)的反应过程中旧键断裂吸收的热量为280 kJ+160 kJ×3=760 kJ,新键生成放出的热量为330 kJ×6=1980 kJ,反应放出1220 kJ的热量,ΔH=-1220 kJ/mol.
知识点
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
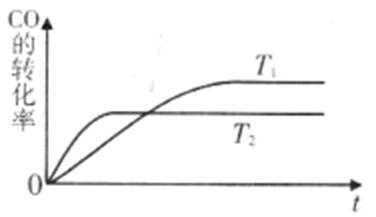
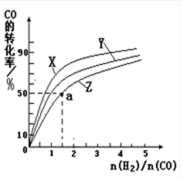
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) 
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 。
正确答案
(1)3 2 8 H2SO4 3 2 2 8 (3分,填上H2SO41分,配平2分)
K2Cr2O7(1分),CO2(1分)
(2)①CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g) △H=-651kJ·mol-1(3分)
②ⅰ)270℃(2分) ⅱ) 4 L2 /mol2(2分,没单位不扣分)
③增大H2的浓度(2分);增大了0.1 mol•L-1(2分)
解析
略
知识点
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
正确答案
解析
本题属于化学反应与能量的考查范畴,虽然《2012年江苏考试说明》中没有提及“活化能”这一概念,但《选修四》课本第3页的绪言中就有这些内容,新课程标准中也有“活化能”这一概念。看来高三复习一定注意要抓课本、抓基础,抓《考试说明》的同时,适当兼顾新课程标准,不能急功近利、顾此失彼。
知识点
下列说法正确的是
正确答案
解析
没有标准状况的条件,不能确定11.2L的O2就是0.5mol,A项错误;温度越高纯净水的PH越低,B项错误。盐酸和醋酸都是一元酸,中和一元酸所需的氢氧化钠的物质的量都相等,C正确;△H 与化学计量数有关,D项错误。
知识点
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g),ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )
正确答案
解析
略
知识点
扫码查看完整答案与解析