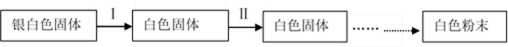- 化学反应原理
- 共2396题
已知
正确答案
解析
略
知识点
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下:
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行:
由乙苯制取苯乙烯反应的
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a、正、逆反应速率的比值恒定 b、c(CO2)=c(CO)
c、混合气体的密度不变 d、CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填
正确答案编号)
a、大于0.5mol/L b、小于0.5mol/L
c、等于0.5mol/L d、不确定
(3)在温度为T2时的恒容器中,乙苯、CO2的起始浓度分别为2.0mol/L和3.0mol/L,设反应平衡后总压强为P、起始压强为

(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
正确答案
(1)+158.8KJ/mol
(2)
(3)
(4)
解析
略
知识点
化学反应中的能量变化是由化学反应中的就化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
正确答案
解析
略
知识点
下列说法中正确的是
正确答案
解析
略
知识点
工业生产水煤气的反应为:C(s)+H2O(g)→CO(g)+H2(g)-131.4 kJ
下列判断正确的是
正确答案
解析
本题考查热化学知识,意在考查考生对概念的理解。由题中信息知合成水煤气反应为吸热反应,故可判知知反应物总能量小于生成物总能量,同时知生成1molH2时需吸收131.4KJ的热量,故A项错、C项正确、D项错;B项中H2O为液态,故B项错。
知识点
CO(g)+H2O(g)
正确答案
解析
催化剂虽然改变了反应途径,但是△H只取决于反应物、生成物的状态,△H不变,A错;这是一个反应前后气体物质的量不变的反应,改变压强,平衡不发生移动,反应放出的热量也不变,B正确;该反应是放热反应,升高温度,平衡左移,反应放出的热量减小,C错;若在原电池中进行,反应不放出热量,而是转换为电能,D错。
知识点
已知
则表中a为
正确答案
解析
本题考查盖斯定律的计算。由已知得:Br2(l)=Br2(g) △H=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);△H= -102KJ/mol。436+a-2×369=-102;a=200KJ,D项正确。
知识点
关于下列四个图象的说法正确的是
正确答案
解析
略
知识点
切开的金属Na暴露在空气中,其变化过程如下:
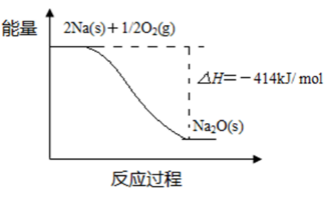
(1)反应Ⅰ的反应过程与能量变化的关系如下:
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
a.升高温度,溶液的pH降低
b.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
c.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
d.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na 
正确答案
见解析。
解析
(1)①放热 反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol
(2)
(3)b c
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
② NiCl2+ 2Na+ + 2e-= Ni +2 NaCl
知识点
11. 下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
greet
正确答案
27.运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g)
①2SO2(g)+O2(g)
②一定条件下,将SO2与
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 
图1 图2 图3
①该反应的平衡常数表达式为_________,升高温度,平衡常数 _____(填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= _______,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为_____________
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____ 点,温度T1 ________ T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 ______性,所得溶液中c(H+)- c(OH-)=_________________(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
正确答案
(1)①< ② be
(2)①k=c2(NH3)/{c(N2)×c3(H2)} 减小
②0.045mol/(L·min) d
③c <
(3)酸性 c(HSO3-) + 2c(SO32-)—c(NH4+)或c(SO32-) + c(NH3·H2O)—c(H2SO3)
解析
解析已在路上飞奔,马上就到!
知识点
11.碘与氢气反应的热化学方程式是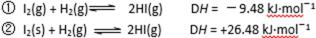
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.已知热化学方程式:C(金刚石,s)+O2(g)=CO2(g) △H1 ①C(石墨,s)+O2(g)=CO2(g) △H2 ①C(石墨,s)=C(金刚石,s)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.已知断裂1 mol F—F、Xe—F键需要吸收的能量分别为157 kJ、130 kJ,则Xe(g)+F2(g) XeF2 (g)的△H为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析