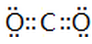- 卤族与氮族及其应用
- 共501题
6.在恒容密闭容器中通入X并发生反应:2X(g) 
正确答案
解析
由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A、温度越高反应速率越大,已知T1>T2,则N点的逆反应速率V逆小于M点的正反应速率V正,故A错误;
B、T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为

C、M点时再加入一定量X,达到的新平衡与原平衡比较,压强增大,增大压强平衡正移,则X的转化率增大,所以M点时再加入一定量X,平衡后X的转化率增大,故C错误;
D、进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故D正确;
考查方向
本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等知识点
解题思路
由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A、温度越高反应速率越大;
B、根据图中X的浓度变化求出Y的浓度变化,再求反应速率;
C、M点时再加入一定量X,达到的新平衡与原平衡比较,根据压强对平衡的影响分析;
D、根据图象判断参加反应的X的量的多少,反应的X越多,放热越多
易错点
C项中转化率的分析
教师点评
本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等知识点,在近几年的各省高考题中出现的频率非常高,常与反应速率、吸放热反应、转化率等知识点交汇命题
知识点
对于大体积混凝土,除应满足棍凝土强度要求外,还应考虑保温措施,拆模之后要保证混凝土内外温差不超过()℃,以免发生温差裂缝。
A.5
B.10
C.15
D.20
正确答案
D
解析
暂无解析
采购与仓库保管费不包括( )。
A.采购人员工资
B.装卸费
C.工资附加费
D.差旅交通费
正确答案
B
解析
采购与仓库保管费指采购、验收、保管和收发设备所发生的各种费用,包括设备采购人员、保管人员和管理人员的工资、工资附加费、办公费、差旅交通费,设备供应部门办公和仓库所,占固定资产使用费、工具用具使用费、劳动保护费、检验试验费等。这些费用可按主管部门规定的采购与保管费费率计算。
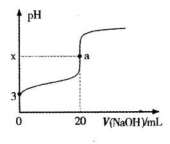
7. 某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)Z元素的原子结构示意图是 ;X和Y的原子半径 
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的离子方程式为
。
(3)一定条件下,1 mol XW3气体与O2完全反应生成X元素的单质和液态水,放出 382.8 kJ热量。该反应的热化学方程式为 。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥分解时会完全转化为气体,其中一种酸性气体的电子式为 。
(5)HR是含

①右图中x 7(填“>”、“<”或“=”)。
②a点时溶液中各种离子浓度由大到小的顺序是 。
正确答案
(1)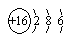

(2)3Cu + 8H+ + NO3-(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O(2分)
(3)NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=—382.8kJ•mol—1,(2分)
或4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=—1531.2 kJ•mol—1(或其他合理答案)
(4) 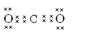
(5) > (2分) c(Na+)>c(R-)>c(OH-)>c(H+) (2分)
解析
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,该铵盐中一定含有N、H元素,且W的原子半径最小,则W为H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一,则ZY2为SO2,Y为O、Z为S元素,故X为N元素:
(1)S原子核外电子数为18,原子结构示意图为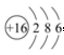
(2)Cu与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
(3)发生反应:4NH3+3O2═2N2+6H2O,4mol氨气反应放出的热量为382.8kJ×4=1531.2kJ,反应热化学方程式为:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ,
Ⅱ.若Z是形成化合物种类最多的元素,则Z为C元素:
(4)该氮肥为碳酸铵或碳酸氢铵,完全分解得到酸性气体为CO2,电子式为:
(5)①a点时两种物质恰好完全反应,则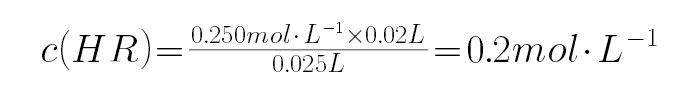
②溶液R-水解,溶液呈碱性,则c(Na+)>c(R-),水解程度微弱,溶液中离子浓度为:c(Na+)>c(R-)>c(OH-)>c(H+)
考查方向
本题考查元素推断、电子式、离子方程式书写、热化学方程式、盐类水解等知识
解题思路
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,该铵盐中一定含有N、H元素,且W的原子半径最小,则W为H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一,则ZY2为SO2,Y为O、Z为S元素,故X为N元素:
(1)S原子核外电子数为18,根据核外电子排布规律画出原子结构示意图;同周期自左而右原子半径减小;
(2)Cu与稀硝酸反应生成硝酸铜、NO与水;
(3)发生反应:4NH3+3O2═2N2+6H2O,计算4mol氨气反应放出的热量,注明物质聚集状态与反应热,书写热化学方程式;
Ⅱ.若Z是形成化合物种类最多的元素,则Z为C元素:
(4)该氮肥为碳酸铵或碳酸氢铵,完全分解得到酸性气体为CO2;
(5)a点时两种物质恰好完全反应,则
,而HR溶液的pH=3,则HR为弱酸,NaR为强碱弱酸盐,溶液呈碱性.
易错点
元素的推断及电子式
教师点评
本题考查元素推断、电子式、离子方程式书写、热化学方程式、盐类水解等知识,在近几年的各省高考题中出现的频率较非常高,试题知识点较多、综合性较强,题目难度中等
知识点
6.分子式为C5H10O2且能与NaHCO3反应放出气体的有机物有(不含立体异构)
正确答案
解析
分子式为C5H10O2且与NaHCO3能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,
-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,故符合条件的有机物的异构体数目为4,
故选C.
考查方向
有机物的同分异构现象
解题思路
分子式为C5H10O2且与NaHCO3溶液能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,丁基异构数等于该有机物的异构体数.
易错点
有机物官能团的性质、同分异构体的书写。
教师点评
本题主要考查同分异构体书写、官能团的性质与确定等,侧重于学生的分析能力的考查,难度中等,熟练掌握碳原子数小于5的烃基的个数是解决本题的关键,甲基与乙基均1种,丙基2种、丁基4种、戊基8种.
知识点
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
正确答案
解析
本题通过NH3的制取实验,意在考查考生实验分析、实验评价能力。①装置在管口处又生成NH4Cl,无法制得NH3,A项错误;选用装置③,使用浓氨水与CaO或NaOH作用,可制取NH3,B项正确;②作为NH3的吸收装置,漏斗插入水中,不能防止倒吸,C项错误;利用④收集NH3时,收集气体不纯,D项错误。
知识点
某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。
资料:在不同温度下,铁粉与水蒸气反应的产物不同。
实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。
13.实验过程中,应先点燃 (选填“酒精灯”或“酒精喷灯”);目的是 ,装置中石棉绒的作用是 。
14.若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是 g。
15.实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。
1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差 ,则气密性良好。
2)装置A中发生的反应方程式 。
3)为了安全,在点燃酒精灯之前,在F装置出口b处必须 。
4)装置C中所放试剂为 ,装置B的作用是 。
5)干燥管E右边又连接干燥管F的目的是 。
若无干燥管F,测得Fe3O4的质量将 (填“偏大”、“偏小”或“无影响”)。
正确答案
酒精灯(1分)先产生水蒸气,排尽空气(2分)增大铁粉与水蒸气接触面积(1分)
考查方向
基本实验操作
解题思路
本题实验目的是研究铁与水蒸气的反应,实验前让水蒸气充满整个试管排走空气,所以先点燃酒精灯。铁粉是固体与水蒸气接触面积小,放在石棉绒上可以增大接触面积,使其充分反应。
教师点评
本题考察了基本的实验操作,比较简单,在高考中出现频率高。
正确答案
4.2
考查方向
根据化学方程式进行计算。
解题思路
56 2 168 8
x 0.2g y 0.2g
x=5.6g y=4.2g
在反应中两个反应都可能发生,所以铁粉的用量在4.2g-5.6g之间。 最小为4.2g
教师点评
本小题考察了根据化学方程式进行计算,不需用到高中知识,在高考中出现概率低。
正确答案
(1)不变(1分)
(2)Zn+2HCl=ZnCl2+H2↑(1分)
(3)验纯(1分)
(4)浓硫酸(1分)除去HCl气体(1分)
(5)防止空气中的二氧化碳和水被E吸收(1分)偏大(2分)
考查方向
实验题考察
解题思路
(1)气密性检查的方法
(2)略
(3)实验安全问题,氢气不纯加热可能发生爆炸
(4)氢气中含有水蒸气会使E出称量质量不准确,故要除去
(5)空气中也有水蒸气,加F可以防止其进入E,保证E收集的水蒸气全部由氢气还原生成的。
教师点评
本题是比较简单的实验考查题,考查的知识浅显易懂,高考出现如此简单大题的概率小。
利用下列装置分别完成相关实验,不能达到实验目的的是
正确答案
解析
略
知识点
用下列装置进行相应实验,能达到实验目的的是
正确答案
解析
略
知识点
33.NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为( )
(2)按图13装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是( ),原因是( ),稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是( ) 。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究 ( )对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为( )(只列出算式,忽略水自身电离的影响)。
正确答案
(1)ACG
(2)①产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,氯化铵小颗粒形成白烟。②烧杯中的石蕊溶液会倒流进入到B瓶中。
(3)①温度
②
③(10-Y×5.35)/m
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析