- 卤族与氮族及其应用
- 共501题
18.氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用。
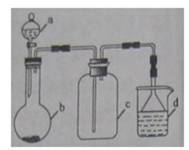
(1)希腊化学家提出采用高质子导电性的SCY陶瓷(能传递H+)为介质,利用右图所示实验装置,实现了高温常压下的电解法合成氨。则装置中B电极连接电源___极,A电极反应式为________________。
(2)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4)。写出上述反应的化学方程式_______________________。
(3)联氨用亚硝酸氧化生成另一种氮的氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式_____。该氢化物可置于安全气 囊,受撞击则完全分解为氮气和氢气,4.30g该氢化物受撞击后产生的气体在标准状况下的体积为_____L。
(4)联氨与盐酸反应生成重要的化工原料盐酸肼(N2H6C12),盐酸胼是易溶于水的强电解质,溶液呈酸性,水解原理与NH4Cl类似。请写出盐酸肼第一步水解反应的离子方程式___________________。下列盐酸肼溶液中的离子浓度关系正确的是_______(填序号)。
a.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
b.c(Cl-)>c(H+)>c([N2H5·H2O]+)>c(OH-)
c.c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-)
d.c(Cl-)=2c(N2H62+)+2c([N2H5·H2O]+)
正确答案
(1)正;6H++N2+6e-=2NH3;
(2)NH3+Cl2=NH2Cl+HCl、NH3+NH2Cl=N2H4+HCl;
(3)HN3;4.48L;
(4)N2H62++H2O
解析
(1)在电解池中,阳离子向阴极移动,H+由B电极向A电极运动,则装置中B电极连接电源正极,A电极反应式为 6H++N2+6e-=2NH3;
(2)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4)。化学方程式为NH3+Cl2=NH2Cl+HCl、NH3+NH2Cl=N2H4+HCl;
(3)联氨用亚硝酸氧化生成另一种氮的氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,分子中氮原子的个数(43.0×0.977)/14≈3,分子中氢原子的个数(43.0-42)=1计算确定该氢化物的分子式HN3;该氢化物可置于安全气囊,受撞击则完全分解为氮气和氢气,2HN3=3N2+H2,4.30g该氢化物为0.1mol,受撞击后产生的气体为0.15molN2和0.05molH2,在标准状况下的体积为4.48L;
(4)联氨与盐酸反应生成重要的化工原料盐酸肼(N2H6Cl2),盐酸胼是易溶于水的强电解质,溶液呈酸性,水解原理与NH4Cl类似。请写出盐酸肼第一步水解反应的离子方程式N2H62++H2O
b.盐酸肼(N2H6Cl2)属于离子化合物,完全电离,N2H62+、[N2H5·H2O]+水解(水解程度是很小的),溶液显酸性,c(Cl-)>c(H+)>c([N2H5·H2O]+)>c(OH-),因此b正确;
c.根据溶液中电荷守恒可知,2c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-),c错误;
d.根据溶液中物料守恒可知,c(Cl-)=2c(N2H62+)+2c([N2H5·H2O]+)+2c([N2H4·2H2O],d错误;
故选ab。
考查方向
解题思路
(1)在电解池中,阳离子向阴极移动;
(2)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4);
(3)联氨用亚硝酸氧化生成另一种氮的氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,分子中氮原子的个数(43.0×0.977)/14≈3,分子中氢原子的个数(43.0-42)=1计算确定该氢化物的分子式HN3;该氢化物可置于安全气囊,受撞击则完全分解为氮气和氢气,2HN3=3N2+H2,4.30g该氢化物为0.1mol,受撞击后产生的气体为0.15molN2和0.05molH2,在标准状况下的体积为4.48L;
(4)联氨与盐酸反应生成重要的化工原料盐酸肼(N2H6Cl2),盐酸胼是易溶于水的强电解质,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一步水解反应的离子方程式N2H62++H2O
b.盐酸肼(N2H6Cl2)属于离子化合物,完全电离,N2H62+、[N2H5·H2O]+水解(水解程度是很小的),溶液显酸性,c(Cl-)>c(H+)>c([N2H5·H2O]+)>c(OH-),因此b正确;
c.根据溶液中电荷守恒可知,2c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-),c错误;
d.根据溶液中物料守恒可知,c(Cl-)=2c(N2H62+)+2c([N2H5·H2O]+)+2c([N2H4·2H2O],d错误;
故选ab。
易错点
溶液中的电荷守恒和物料守恒
知识点
13、实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列有关实验原理或操作正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。
根据上述实验情况,以下说法错误的是( )
正确答案
考查方向
解题思路
①第一份加入足量盐酸,产生气体在空气中变为红色,红色气体为NO2,则H+、Fe2+、NO3-发生氧化还原反应生成NO,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生,沉淀为硫酸钡沉淀,所以一定存在SO42-;
②第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出,则气体为氨气,一定含NH4+;加过量NaOH生成的沉淀为氢氧化亚铁,可能含氢氧化铁,则可能含Fe3+,综上所述,一定含Fe2+、NH4+、SO42-、NO3-,可能含Na+、I-,以此来解答。
易错点
本题考查物质或离子的检验,为高频考点,把握离子之间的反应及反应现象推断离子为解答的关键,侧重分析与推断能力的考查,注意利用电话守恒分析铁离子为解答的难点,题目难度中等。
知识点
9.依据反应原理:NH3+CO2+H2O+NaCl==NaHCO3↓+NH4Cl,并利用下列装置制取碳酸氢钠粗品,实验装置正确且能达到实验目的的是
正确答案
解析
A选项中NH4Cl受热分解后如果遇冷又会形成固体堵塞导气管,所以A错;稀硫酸与石灰石反应产生CaSO4,CaSO4是难溶物,会堵塞长颈漏斗,所以B错;结合题目中的化学反应方程式可以得出C正确;用装置丁分离碳酸氢钠与母液时,漏斗下端应该紧贴烧杯壁,所以D错。
考查方向
解题思路
先看图中实验仪器的使用有无错误,再结合题目所给的化学反应方程式结合图来判断即可。
易错点
NH4Cl受热分解后如果遇冷又会形成固体堵塞导气管,如果分析不透彻,就会出错,随教材上所要求的实验操作粗心大意,也会导致本题出错。
知识点
利用下列装置分别完成相关实验,不能达到实验目的的是
正确答案
解析
略
知识点
用下列装置进行相应实验,能达到实验目的的是
正确答案
解析
略
知识点
下列装置或操作不能实现实验目的的是
正确答案
解析
略
知识点
9.下列实验装置或操作正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.下图所示为制取干燥的氨气,并验证氨的某些性质,请根据要求回答下列问题

NO+ NO2+ NaOH= NaNO2+ H2O
用该原理处理为气的不足之处是( );
(2)上述装置接口的连接顺序为( ) (填小写字母)。
(3)如何检验装置A的气密性:( )。
实验中观察到D内有红棕色气体出现,证明氨气具有( )性。
(4)右图所示为实验室制取氨气的发生装置,请在虚线框内画出收集氨气的装置图。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析