- 卤族与氮族及其应用
- 共501题
研究含氮、碳化合物的性质对它们的综合利用有重要意义。
23.反应NO+O3=NO2+O2,若生成11.2 L O2(标准状况)时,转移电子的物质的量是
Mol

已知:2SO2(g)+O2(g)

写出N
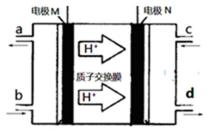
25.N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图所示。M电极发生的电极反应式为
26.已知CO (g) +H

①一定条件下反应达到平衡状态后,若改变反应的某个条件,下列变化能说
A.逆反应速率先增大后减小
B.H2 O (g)的体积百分含量减小
C.CO的转化率增大
D.容器中c(CO2)/c(CO)的值减小
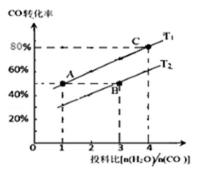
②在某压强下,上述反应在不同温度、不同投料比时, CO的转化率如图所示。则KA、KB、KC三者之间 的大小关系为 T1温度下,将1molCO和4mol H2O (g)充入2L的密 闭容器中,5min后反应达到平衡状态,则0~5min 内的
正确答案
1
解析
NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
考查方向
解题思路
化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
正确答案
2NO(g)+O2(g) = 2NO2(g) ΔH=-113.0 kJ/mol
解析
已知:A、NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8kJ•mol﹣1;
B、2SO2(g)+O2(g)=2SO3(g)△H=﹣196.6kJ•mol﹣1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B﹣2A得到的,所以该反应的△H=﹣196.6kJ•mol﹣1﹣2(﹣41.8kJ•mol﹣1)=﹣113.0 kJ•mol﹣1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=﹣113.0 kJ•mol﹣1;
考查方向
解题思路
A、NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8kJ•mol﹣1;B、2SO2(g)+O2(g)=2SO3(g)△H=﹣196.6kJ•mol﹣1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B﹣2A得到的,根据盖斯定律结合热化学方程式的书写来回答;
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
正确答案
N2H4-4e-=N2↑+4H+
解析
由氢离子的移动方向可知,M区为负极,发生的电极反应式为N2H4﹣4e﹣=N2↑+4H+,故答案为:N2H4﹣4e﹣=N2↑+4H+;
考查方向
解题思路
由氢离子的移动方向可知,M区为负极,发生失电子的氧化反应;
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
正确答案
① C
② KA= KC >KB 0.08mol·L-1·min-1 
解析
①A.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故A错误;
B.H2O(g)的体积百分含量减小,可能是增大生成物浓度,平衡不一定正向移动,故B错误;
C.CO的转化率增大,平衡正向移动,故C正确;
D.容器中的二氧化碳和氢气浓度比值变小,可能是减小二氧化碳的物质的量,平衡逆向移动,故D错误,
故选:C;
②平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,反应是吸热反应,所以升高温度,平衡正向移动,CO的转化率增加,T2<T1,温度越高,K越大,所以KA=KC>KB,T1温度下,将1molCO和4mol H2O (g)充入2L的密闭容器中,5min后反应达到平衡状态,此时CO的转化率是80%,则0~5min内的平均反应速率v(CO)=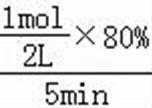
此时K=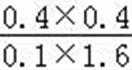
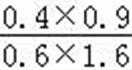
故答案为:0.08mol•L﹣1•min﹣1;>.
考查方向
解题思路
①A.逆反应速率先增大后减小,可能是增大生成物浓度;
B.H2的转化率增大,平衡一定正向移动;
C.反应物的体积百分含量减小,可能是增大生成物浓度等;
D.容器中的二氧化碳和氢气浓度比值变小,可能是减小二氧化碳的物质的量.
②根据平衡常数仅与温度有关,温度不变,平衡常数不变,T1温度下,根据平均反应速率v(CO)=
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
下列实验方案中,不能达到实验目的的是
正确答案
解析
略
知识点
下列叙述中正确的是
正确答案
解析
试题分析:A. 不一定会有白色沉淀,酚羟基的邻位和对位没有氢原子可取代时,即是不能被溴取代;B.氮化硅陶瓷从元素的角度属于非金属材料,正确;C.浓硝酸会氧化橡胶,应用玻璃塞,错误;D.淀粉和纤维素不能讲分子式为(C6H10O5)n,因为它们的n值不一样,只能说通式。
知识点
利用下图所示装置进行下列实验,能得出相应实验结论的是
正确答案
解析
略
知识点
下列现象或事实可用同一原理解释的是
正确答案
解析
略
知识点
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
1 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
正确答案
见解析。
解析
(1)① 强氧化性
② O2
(2)Ⅰ①
② 2NO2 + 2NaOH 
Ⅱ① 2NO2 + 2C 点燃 N2 + 2CO2
② 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧
中燃烧的实验。
③主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体均存在。
知识点
下列试剂中,标签上应标注

正确答案
解析
略
知识点
下列实验能达到目的的是
正确答案
解析
A:两者密度都比水小,均发生萃取,溴水层褪色。B.两者都有沉淀生成。C.两者均能与NaHCO3溶液反应,而且引入CO2.
知识点
下列实验“操作和现象”与“结论”对应关系正确的是
正确答案
解析
向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A项错误。应加入碱将水解后的淀粉溶液调节成碱性,才可以产生红色沉淀,B项错误。乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,也可以使酸性KMnO4溶液褪色,C项错误。饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,D项正确。
知识点
下列各项两种物质间发生反应,消耗等物质的量的酸,产生气体最多的是
正确答案
解析
略。
知识点
扫码查看完整答案与解析