- 卤素原子结构及其性质的比较
- 共92题
5.美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如下图所示),下列有关说法正确的是( )
正确答案
解析
A.设计该循环是为了制取能源气体H2和常见氧化剂O2,错误;
B.整个循环过程中产生1mol O2的同时产生2mol氢气,标准状况下体积为44.8LH2,错误;
C.图中反应Ⅰ、Ⅱ、Ⅲ三个反应均有元素的化合价变化,均为氧化还原反应,正确;
D.反应Ⅰ:SO2+I2+2H2O=H2SO4+2HI,单质碘氧化性较强,反应Ⅰ可在常温常压下进行;
反应Ⅱ:2H2SO4
反应Ⅲ:2HI
故选C。
考查方向
解题思路
反应Ⅰ:SO2+I2+2H2O=H2SO4+2HI;反应Ⅱ:2H2SO4

A.能源气体H2和常见氧化剂O2;
B.2mol氢气标准状况下体积为44.8LH2;
C.图中反应Ⅰ、Ⅱ、Ⅲ三个反应均有元素的化合价变化,均为氧化还原反应;
D.反应Ⅰ:SO2+I2+2H2O=H2SO4+2HI,单质碘氧化性较强,反应Ⅰ可在常温常压下进行;
反应Ⅱ:2H2SO4
反应Ⅲ:2HI
易错点
本题综合考查物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析能力、计算能力和实验能力的考查,注意把握实验方案的设计以及相关实验操作,难度不大,答题时注意正确获取题给信息。
知识点
13.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
正确答案
解析
A.由于硝酸钾的溶解度随温度变化比较大,而溴酸银的溶解度随温度变化不大,所以若硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故A错误;
B.温度升高,溴酸银溶解在水中的微粒运动速度加快,扩散的更快,故溶解速度加快,故B正确;
C.60℃溴酸银的溶解度大约是0.6g.则
D.由溶解度随温度的变化关系可知:温度升高,该物质的溶解度增大,可见溴酸银(AgBrO3)溶解是吸热过程 ,故D正确。
故选A。
考查方向
解题思路
A.由于硝酸钾的溶解度随温度变化比较大,而溴酸银的溶解度随温度变化不大;
B.温度升高,溴酸银溶解在水中的微粒运动速度加快,扩散的更快,故溶解速度加快;
C.60℃溴酸银的溶解度大约是0.6g.则
D.由溶解度随温度的变化关系可知:温度升高,该物质的溶解度增大,可见溴酸银(AgBrO3)溶解是吸热过程 。
易错点
本题考查溶解度的概念及相关计算,难度中等.要注意重结晶方法的使用对象。
知识点
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。
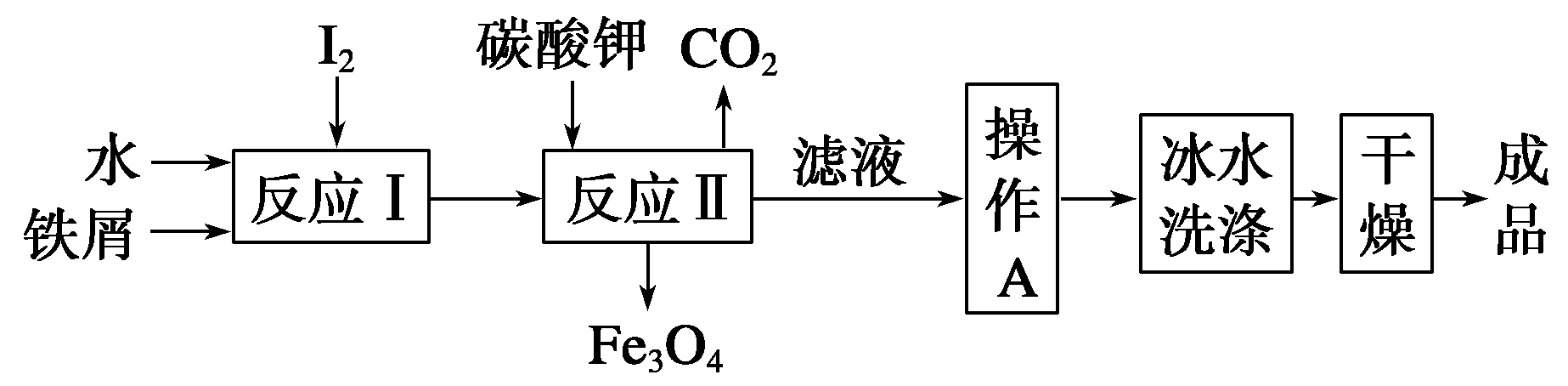
29.工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应Ⅰ生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21∶127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为____________________。
②操作A包括__________________;用冰水洗涤的目的是__________________。
30.KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是______________________________。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水________ kg。
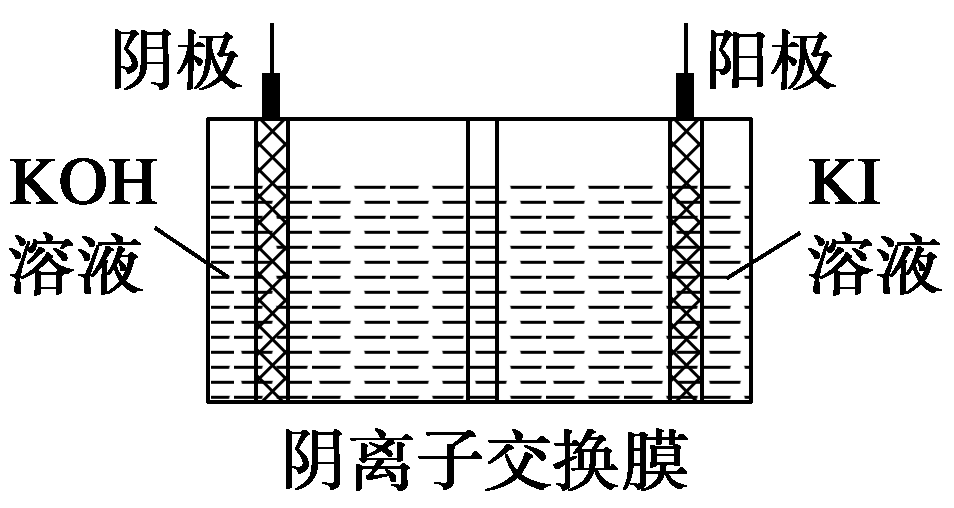
③KIO3还可通过下图所示原理进行制备。电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比________(选填“增大”、“减小”或“不变”)。
正确答案
①Fe3I8+4K2CO3==Fe3O4+8KI+4CO2↑
②蒸发浓缩、冷却结晶、过滤 洗涤除去表面可溶性杂质的同时减少KI的溶解损失
解析
①、根据铁元素与碘元素的质量比为21:127,铁、碘原子个数比为8:3,反应Ⅰ生成物化学式是 Fe3I8,反应Ⅱ的反应方程式是:Fe3I8+4K2CO3==Fe3O4+8KI+4CO2↑;故答案是:Fe3I8+4K2CO3==Fe3O4+8KI+4CO2↑;
②、反应Ⅱ的滤液需要经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;由于碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,故用冰水洗涤;故答案是:加热浓缩、冷却结晶、过滤; 洗涤除去表面可溶性杂质,同时减少KI的溶解损失.
考查方向
解题思路
①、铁元素与碘元素的质量比为21:127,铁、碘原子个数比为8:3,反应Ⅰ生成了Fe3I8,反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁和二氧化碳的反应,Fe3I8+4K2CO3==Fe3O4+8KI+4CO2↑;
②、得到碘化钾,需要经过加热浓缩、冷却结晶、过滤,再降温、干燥得到碘化钾固体;冰水洗涤的目的是:洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
易错点
本题考查了制取及提纯碘化钾、碘酸钾的方法,题中内容较多,难度稍大。
正确答案
①Fe3I8+4K2CO3==Fe3O4+8KI+4CO2↑
②蒸发浓缩、冷却结晶、过滤 洗涤除去表面可溶性杂质的同时减少KI的溶解损失
解析
①、由于碘酸钾的热稳定性较差,烹饪时,含KIO3的食盐常在出锅前加入;
故答案是:在较高温度下K1O3易分解;
②、1284kg KIO3固体的物质的量是6kmol,根据化合价升降相等,I2→IO3-化合价升高5价、H2O2→H2O化合价降低2价,关系式为:2KIO3~5H2O2
n(H2O2)=5/2n(IO3-)=5/2×6kmol=15kmol;消耗质量分数为30%的双氧水的质量为:

③、图2中,阴极水中的氢离子得到电子生成氢气,阳极碘离子失去电子变成碘酸根离子,正反应为:I-+3H2O═IO3-+3H2↑;
阴极水得电子生成氢气,观察到的实验现象是有气泡产生;
若忽略溶液体积的变化,则电解结束后产生氢氧根离子,阴极区的pH与电解前相比增大;
故答案是:I-+3H2O═IO3-+3H2↑;有气泡产生;增大
考查方向
解题思路
①、碘酸钾加热容易分解,热稳定性差;
②、KIO3的摩尔质量是214g/mol,1284kg 固体的物质的量是6mol;根据化合价升降相等列出碘酸钾和双氧水的关系式:2KIO3~5H2O2;求出双氧水的物质的量,再计算出双氧水溶液的质量;
③、碘离子失去电子变成碘酸根离子、水中的氢离子得到电子生成氢气,反应离子方程式是:I-+3H2O═IO3-+3H2↑; 根据电解总反应方程式可知,电解结束后阴极区的pH与电解前没有变化。
易错点
本题考查了制取及提纯碘化钾、碘酸钾的方法,题中内容较多,难度稍大。
10.下列有关实验操作、现象和结论均正确的是
正确答案
D
解析
A:溴水加入苯中后,溴单质从水溶液中被苯萃取溶于苯中,属于物理反应.
B:SO2溶于水后与水反应生成H2SO3,弱酸,电解后H+与NO3-和SO32-进行氧化还原反映,形成产物之一SO42-,与Ba2+反应生成BaSO4沉淀,故B错;
C:不能有产生H2的量的多少来判定酸的强弱。
D:Br2与I-发生置换反应,生成Br-和I2,CCl4将I2萃取溶于其中,使其呈现紫色,故由该反应得知Br2的氧化性强于I2;
考查方向
考查由化学反应实验中的操作与产生的现象和解释是否匹配,也是实验基础内容的考查。
解题思路
A中Br2溶液加入苯中,Br2更容易溶于有机苯中,属于物理反应中的萃取;
B:SO2通入溶液中先与水反应SO2+H2O ⇌ H2SO3, H2SO3⇌2H++SO32-,
3SO32-+2NO3-+2H+=3SO42-+2NO↑+H2O,SO42-+Ba2-=BaSO4↓(沉淀)
C:放出的H2的量的多少不能判定是否是强酸
易错点
A中的属于物理反应,容易和化学发应现象混淆;B:忽略了NO3-和SO32-在H+环境下发生的氧化还原反应;C:弱酸溶液中部分弱酸处于未电离状态,了解弱酸的特性及其定义,D:氧化还原反应的定义配合反应方程式理解;
知识点
为了测定含氰废水中CN-的含量,某化学小组利用下图所示装置进行实验。关闭活塞a,将100 mL含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应后,打开活塞b,滴入稀H2SO4溶液,然后关闭活塞b。
已知装置B中发生的主要反应为:
CN-+ClO-===CNO-+Cl-
2CNO+2H++3C1O-==N2↑+2CO2↑+3C1-+H2O
副反应为:Cl-+ClO-+2H+=C12↑+H2O
24.装置D的作用是_______________。
25.反应过程中,装置C中的实验现象为________________。
26.待装置B中的反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是_______________________________________________
27.反应结束后,装置C中生成39.4 mg沉淀,则废水中c(CN-)=____mol·L-1。
28.对上述实验装置进行合理改进,可通过直接测量装置C反应前后的质量变化,测定废水中CN-的含量。设计合理实验方案_____________。
仪器自选。
供选的试剂:浓硫酸、NaOH溶液、饱和食盐水、饱和NaHCO3溶液、CCl4。
29.利用右图所示装置可以除去废水中的CN-。控制溶液pH为5.2~6.8时,CN-转化为C2O42-和NH4+。
①气体a的化学式为_____________。
②阳极的电极反应式为______________。
正确答案
防止空气中的CO2进入到C装置
解析
根据装置B中发生的主要反应为:CN-+ClO-===CNO-+Cl- ,2CNO+2H++3C1O-==N2↑+2CO2↑+3C1-+H2O 副反应为:Cl-+ClO-+2H+=C12↑+H2O ,就可以知道B装置中是CN-,ClO-与H+反应最终产生的是N2,CO2。N2,CO2会通过导气管进入到C装置中,C中装的是滴有酚酞的足量的Ba(OH)2溶液,其中酚酞遇到足量的Ba(OH)2会变红色,产物中的CO2会与Ba(OH)2反应产生BaCO3,N2不参加反应。为了防止空气中的CO2进入C中,给实验带来影响,所以装置D的目的就是阻止空气中的CO2进入。
考查方向
解题思路
首先熟悉装置图流程,要了解加入的化学物质的作用及原理,通过题中所给的相关信息,综合考虑试验中各个环节的机制原理,对各个环节的目的都要做到心中有数,会根据所给的化学方程式计算,分析好电解池中的反应原理。
易错点
对各个装置中的作用不了解,流程中的各个环节的作用及原理和目的分析错误,还有在此过程中的加入的各种化学物质的作用及产生的现象不甚了解,对实验中存在的缺陷及改进措施不能独立设计和改进,都会导致本题出现失误
正确答案
有白色沉淀生成,溶液红色褪去
解析
ClO-与H+反应最终产生的是N2,CO2。N2,CO2会通过导气管进入到C装置中,C中装的是滴有酚酞的足量的Ba(OH)2溶液,其中酚酞遇到足量的Ba(OH)2会变红色,产物中的CO2会与Ba(OH)2反应产生BaCO3,N2不参加反应,CO2会消耗碱,所以C中的现象是出现白色沉淀,红色溶液会褪去。
考查方向
实验操作及规范,实验设计方案的改进,化学反应原理及其各物质的利用和各物质的物理性质及化学性质的考查,及实验后数据的处理,电化学的相关知识。
解题思路
首先熟悉装置图流程,要了解加入的化学物质的作用及原理,通过题中所给的相关信息,综合考虑试验中各个环节的机制原理,对各个环节的目的都要做到心中有数,会根据所给的化学方程式计算,分析好电解池中的反应原理。
易错点
对各个装置中的作用不了解,流程中的各个环节的作用及原理和目的分析错误,还有在此过程中的加入的各种化学物质的作用及产生的现象不甚了解,对实验中存在的缺陷及改进措施不能独立设计和改进,都会导致本题出现失误
正确答案
将反应产生的CO2全部转入C装置中并被Ba(OH)2完全吸收
解析
CO2的密度比空气大,少量的CO2气体不会沿着导气管进入到C装置中,为了让所有的CO2进入到C装置中,可以在B装置前通入空气,通入空气会使B中产生的CO2全部进入到C中和Ba(OH)2反应,减少物质的损失而带来的计算失误,但通入的空气首先应该通过NaOH溶液里,是为了吸收掉空气中的CO2等能和Ba(OH)2反应的气体,所以待装置B中的反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是将反应产生的CO2全部转入C装置中并被Ba(OH)2完全吸收
考查方向
实验操作及规范,实验设计方案的改进,化学反应原理及其各物质的利用和各物质的物理性质及化学性质的考查,及实验后数据的处理,电化学的相关知识。
解题思路
首先熟悉装置图流程,要了解加入的化学物质的作用及原理,通过题中所给的相关信息,综合考虑试验中各个环节的机制原理,对各个环节的目的都要做到心中有数,会根据所给的化学方程式计算,分析好电解池中的反应原理。
易错点
对各个装置中的作用不了解,流程中的各个环节的作用及原理和目的分析错误,还有在此过程中的加入的各种化学物质的作用及产生的现象不甚了解,对实验中存在的缺陷及改进措施不能独立设计和改进,都会导致本题出现失误
正确答案
0.002
解析
反应结束后,装置C中生成39.4 mg沉淀,根据碳元素守恒,列式计算:
考查方向
实验操作及规范,实验设计方案的改进,化学反应原理及其各物质的利用和各物质的物理性质及化学性质的考查,及实验后数据的处理,电化学的相关知识。
解题思路
首先熟悉装置图流程,要了解加入的化学物质的作用及原理,通过题中所给的相关信息,综合考虑试验中各个环节的机制原理,对各个环节的目的都要做到心中有数,会根据所给的化学方程式计算,,分析好电解池中的反应原理。
易错点
对各个装置中的作用不了解,流程中的各个环节的作用及原理和目的分析错误,还有在此过程中的加入的各种化学物质的作用及产生的现象不甚了解,对实验中存在的缺陷及改进措施不能独立设计和改进,都会导致本题出现失误
正确答案
在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶
解析
在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶,这样就可以排除掉其他部分的干扰。
考查方向
实验操作及规范,实验设计方案的改进,化学反应原理及其各物质的利用和各物质的物理性质及化学性质的考查,及实验后数据的处理,电化学的相关知识。
解题思路
首先熟悉装置图流程,要了解加入的化学物质的作用及原理,通过题中所给的相关信息,综合考虑试验中各个环节的机制原理,对各个环节的目的都要做到心中有数,会根据所给的化学方程式计算,,分析好电解池中的反应原理。
易错点
对各个装置中的作用不了解,流程中的各个环节的作用及原理和目的分析错误,还有在此过程中的加入的各种化学物质的作用及产生的现象不甚了解,对实验中存在的缺陷及改进措施不能独立设计和改进,都会导致本题出现失误
正确答案
① H2
② 2CN-+4H2O-2e-=C2O42-+2NH4+
解析
①废水中的阴离子有CN-和OH-,阳离子有H+,电解废水时,阴极上的电极反应式为2H++2e-=H2,所以气体a为H2。②题目中说道:控制溶液pH为5.2~6.8时,CN-转化为C2O42-和NH4+。根据得失电子数守恒,阳极反应式为:2CN-+4H2O-2e-=C2O42-+2NH4+
考查方向
实验操作及规范,实验设计方案的改进,化学反应原理及其各物质的利用和各物质的物理性质及化学性质的考查,及实验后数据的处理,电化学的相关知识。
解题思路
首先熟悉装置图流程,要了解加入的化学物质的作用及原理,通过题中所给的相关信息,综合考虑试验中各个环节的机制原理,对各个环节的目的都要做到心中有数,会根据所给的化学方程式计算,分析好电解池中的反应原理。
易错点
对各个装置中的作用不了解,流程中的各个环节的作用及原理和目的分析错误,还有在此过程中的加入的各种化学物质的作用及产生的现象不甚了解,对实验中存在的缺陷及改进措施不能独立设计和改进,都会导致本题出现失误
扫码查看完整答案与解析