- 卤素原子结构及其性质的比较
- 共92题
【化学——物质结构与性质】
已知元素A、B、C、D、E均属前四周期元素,且原子序数依次增大。元素A原子的核外电子有6种不同的运动状态,元素C原子的最外层电子数是其内层电子数的3倍,元素D的一种常见单质为淡黄色晶体,元素E原子的内部各能层均排满,且最外层电子数为1。
30.五种元素中电负性最大的是____(填元素符号),其中E的基态原子的核外电子排布式为_____。
31.元素A在形成化合物时,其键型以共价键为主,原因是_______________________。在第2周期元素中,第一电离能大于B的元素有_____种。
32.AD2分子中,共价键的类型有_____;BC3-中,B原子的杂化轨道类型是______;与BC3-互为等电子体的微粒的化学式为______(写出一种即可)。
33.向D的硫酸盐溶液中滴加氨水直至过量,观察到的现象是______,上述过程的离子方程式为_________。

正确答案
O [Ar]3d104s1 或 1s22s22p63s23p63d104s1
解析
已知元素A、B、C、D、E均属前四周期元素,且原子序数依次增大。元素A原子的核外电子有6种不同的运动状态,所以A是6号元素C(碳);元素C原子的最外层电子数是其内层电子数的3倍,所以C是氧元素;元素D的一种常见单质为淡黄色晶体,前四周期中,淡黄色晶体单质只有硫,所以D是硫元素;元素E原子的内部各能层均排满,且最外层电子数为1,元素A、B、C、D、E均属前四周期元素,且原子序数依次增大,所以E失铜;A:C B:N C:O D:S E:Cu 五种元素中电负性最大O,离F越近,电负性越大,E的基态原子的核外电子排布式为[Ar]3d104s1 或 1s22s22p63s23p63d104s1
考查方向
本题考查的是高中化学选修三的晶体结构,原子结构,元素周期律,以及电负性和电力能的概念的考查,主要是元素的推断及元素的周期性变化的考查,还有晶体结构中密度、质量、原子个数计算等的考查
解题思路
先推断出各个元素,按照题目中的要求仔细审题,对原子轨道及其所形成的化合物的杂化轨道做出准确判断,然后根据图示,要求计算其原子个数。
易错点
推断能力差,就会导致本题出现严重的错误。能推断出各种元素,其中电离能、电负性、键的类型的知识的不巩固,都会到会错误,而且晶体结构中,晶胞中的原子个数的计算能力差,也会出现失分。
正确答案
碳原子有4个价电子且半径较小,难以通过得或失电子达到稳定电子结构 2
解析
已知元素A、B、C、D、E均属前四周期元素,且原子序数依次增大。元素A原子的核外电子有6种不同的运动状态,所以A是6号元素C(碳);元素C原子的最外层电子数是其内层电子数的3倍,所以C是氧元素;元素D的一种常见单质为淡黄色晶体,前四周期中,淡黄色晶体单质只有硫,所以D是硫元素;元素E原子的内部各能层均排满,且最外层电子数为1,元素A、B、C、D、E均属前四周期元素,且原子序数依次增大,所以E失铜;A:C B:N C:O D:S E:Cu 碳元素形成化合物时,其键型以共价键为主,原因是碳原子有4个价电子且半径较小,难以通过得或失电子达到稳定电子结构;在第2周期元素中,第一电离能大于B的元素有F、Ne 2种元素
考查方向
解题思路
先推断出各个元素,按照题目中的要求仔细审题,对原子轨道及其所形成的化合物的杂化轨道做出准确判断,然后根据图示,要求计算其原子个数。
易错点
推断能力差,就会导致本题出现严重的错误。能推断出各种元素,其中电离能、电负性、键的类型的知识的不巩固,都会到会错误,而且晶体结构中,晶胞中的原子个数的计算能力差,也会出现失分。
正确答案
σ键和π键, SP3 SO3、BF3、CO32-等
解析
已知元素A、B、C、D、E均属前四周期元素,且原子序数依次增大。元素A原子的核外电子有6种不同的运动状态,所以A是6号元素C(碳);元素C原子的最外层电子数是其内层电子数的3倍,所以C是氧元素;元素D的一种常见单质为淡黄色晶体,前四周期中,淡黄色晶体单质只有硫,所以D是硫元素;元素E原子的内部各能层均排满,且最外层电子数为1,元素A、B、C、D、E均属前四周期元素,且原子序数依次增大,所以E失铜;A:C B:N C:O D:S E:Cu AD2分子是CS2,CS2中有2个π键和2个σ键,所以键的类型有π键和σ键;BC3-是NO3-,其中N的杂化类型是SP3;与NO3-互为等电子体的有SO3、BF3、CO32-等。
考查方向
解题思路
先推断出各个元素,按照题目中的要求仔细审题,对原子轨道及其所形成的化合物的杂化轨道做出准确判断,然后根据图示,要求计算其原子个数。
易错点
推断能力差,就会导致本题出现严重的错误。能推断出各种元素,其中电离能、电负性、键的类型的知识的不巩固,都会到会错误,而且晶体结构中,晶胞中的原子个数的计算能力差,也会出现失分。
正确答案
σ键和π键, SP3 SO3、BF3、CO32-等
解析
已知元素A、B、C、D、E均属前四周期元素,且原子序数依次增大。元素A原子的核外电子有6种不同的运动状态,所以A是6号元素C(碳);元素C原子的最外层电子数是其内层电子数的3倍,所以C是氧元素;元素D的一种常见单质为淡黄色晶体,前四周期中,淡黄色晶体单质只有硫,所以D是硫元素;元素E原子的内部各能层均排满,且最外层电子数为1,元素A、B、C、D、E均属前四周期元素,且原子序数依次增大,所以E失铜;A:C B:N C:O D:S E:Cu 向D的硫酸盐溶液中滴加氨水直至过量发生的离子反应式是Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,产生的现象就是先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到蓝色的澄清溶液
考查方向
解题思路
先推断出各个元素,按照题目中的要求仔细审题,对原子轨道及其所形成的化合物的杂化轨道做出准确判断,然后根据图示,要求计算其原子个数。
易错点
推断能力差,就会导致本题出现严重的错误。能推断出各种元素,其中电离能、电负性、键的类型的知识的不巩固,都会到会错误,而且晶体结构中,晶胞中的原子个数的计算能力差,也会出现失分。
正确答案
4 288/a3·NA
解析
已知元素A、B、C、D、E均属前四周期元素,且原子序数依次增大。元素A原子的核外电子有6种不同的运动状态,所以A是6号元素C(碳);元素C原子的最外层电子数是其内层电子数的3倍,所以C是氧元素;元素D的一种常见单质为淡黄色晶体,前四周期中,淡黄色晶体单质只有硫,所以D是硫元素;元素E原子的内部各能层均排满,且最外层电子数为1,元素A、B、C、D、E均属前四周期元素,且原子序数依次增大,所以E失铜;A:C B:N C:O D:S E:Cu C和E能够形成化合物F,F是CuO或是Cu2O,其晶胞结构如右图所示,晶胞中C原子的配位数为体心上的一个白点周围有4个黑点,所以其配位数为4;若晶胞边长为a cm,利用其公式ρV=m=N •M /NA,所以ρ=N •M /NA •V,其中V=a3,NA是定值,确定其分子式:黑点是Cu,有4个 ,白点是O,有8×1 /8+1=2,所以形成的分子式为Cu2O,所以N=2,M=64×2+16=144,代入公式计算,求得ρ=288/a3·NA
考查方向
解题思路
先推断出各个元素,按照题目中的要求仔细审题,对原子轨道及其所形成的化合物的杂化轨道做出准确判断,然后根据图示,要求计算其原子个数。
易错点
推断能力差,就会导致本题出现严重的错误。能推断出各种元素,其中电离能、电负性、键的类型的知识的不巩固,都会到会错误,而且晶体结构中,晶胞中的原子个数的计算能力差,也会出现失分。
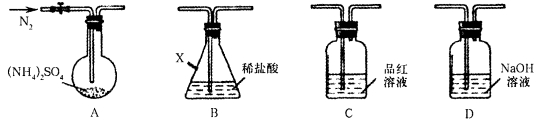
(NH4)2SO4俗称硫铵,常用作氮肥和化工原料。查阅资料发现(NH4)2SO4在260℃和400℃时分解产物不同。现选用下图所示装置进行实验(夹持和加热装置略)对其分解产物进行实验探究。
21.连接装置A—B—C—D,检查气密性,按图示加入试剂(装置B盛0.2000mol/L盐酸100.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.1000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
①仪器X的名称是___________。实验中开始加热后还要继续通入氮气的目的是___________。品红溶液不褪色和滴定后B的溶液中无SO42-,说明该条件下硫铵的分解产物除了NH3外还有______________。
②滴定前,要排尽滴定管尖嘴的气泡,其操作方法为___________。通过滴定测得装置B内溶液吸收NH3的物质的量是___________。
22.连接装置A—D—B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
①若用HNO3酸化的Ba(NO3)2检验装置D内溶液中是否存在SO32-,是否合理,理由是______________。
②(NH4)2SO4在400℃分解的化学方程式是___________,单位物质的量的硫铵完全分解转移电子的物质的量为__________mol。
正确答案
①锥形瓶 将A中产生的气体全部排出,被后面装置中的试剂吸收 H2SO4
②大拇指和食指的指尖挤压玻璃球,并将尖嘴部分向上翘起 0.0175mol
解析
(NH4)2SO4俗称硫铵,常用作氮肥和化工原料。查阅资料发现(NH4)2SO4在260℃和400℃时分解产物不同。现选用下图所示装置进行实验(夹持和加热装置略)对其分解产物进行实验探究。连接装置A—B—C—D,检查气密性,按图示加入试剂(装置B盛0.2000mol/L盐酸100.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.1000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
①仪器X的名称是锥形瓶。为了将A中产生的气体全部排出,被后面装置中的试剂吸收,实验开始加热后还要继续通入氮气。品红溶液不褪色和滴定后B的溶液中无SO42-,说明该条件下硫铵的分解产物除了NH3外还有H2SO4;
②滴定前,要排尽滴定管尖嘴的气泡,其操作方法为大拇指和食指的指尖挤压玻璃球,并将尖嘴部分向上翘起。通过滴定测得装置B内溶液吸收NH3的物质的量是0.2000mol/L×0.1L-0.1000mol/L×0.25L=0.0175mol。
考查方向
解题思路
①仪器X的名称是锥形瓶。为了将A中产生的气体全部排出,被后面装置中的试剂吸收,实验开始加热后还要继续通入氮气。品红溶液不褪色和滴定后B的溶液中无SO42-,说明该条件下硫铵的分解产物除了NH3外还有H2SO4;
②滴定前,要排尽滴定管尖嘴的气泡,其操作方法为大拇指和食指的指尖挤压玻璃球,并将尖嘴部分向上翘起。通过滴定测得装置B内溶液吸收NH3的物质的量是0.2000mol/L×0.1L-0.1000mol/L×0.25L=0.0175mol。
易错点
解题的关键是注意(NH4)2SO4在400℃分解,生成氨气、氮气、二氧化硫和水,在反应中,氮元素化合价上升,失去电子生成氮气;硫元素化合价降低,得到电子生成二氧化硫;3mol (NH4)2SO4分解3molSO2,得电子6mol。
正确答案
①不合理,因为无论溶液中存在SO32- 还是SO42- 均会产生同样的现象
②3(NH4)2SO4 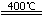
解析
(NH4)2SO4俗称硫铵,常用作氮肥和化工原料。查阅资料发现(NH4)2SO4在260℃和400℃时分解产物不同。现选用下图所示装置进行实验(夹持和加热装置略)对其分解产物进行实验探究。连接装置A—D—B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
①不能用HNO3酸化的Ba(NO3)2检验装置D内溶液中是否存在SO32-,因为无论溶液中存在SO32- 还是SO42- 均会产生同样的现象,生成白色沉淀;
②(NH4)2SO4在400℃分解,生成氨气、氮气、二氧化硫和水,化学方程式是3(NH4)2SO4 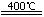
考查方向
解题思路
①不能用HNO3酸化的Ba(NO3)2检验装置D内溶液中是否存在SO32-,因为无论溶液中存在SO32- 还是SO42- 均会产生同样的现象,生成白色沉淀;
②(NH4)2SO4在400℃分解,生成氨气、氮气、二氧化硫和水,在反应中,氮元素化合价上升,失去电子生成氮气;硫元素化合价降低,得到电子生成二氧化硫;3mol (NH4)2SO4分解3molSO2,得电子6mol。
易错点
解题的关键是注意(NH4)2SO4在400℃分解,生成氨气、氮气、二氧化硫和水,在反应中,氮元素化合价上升,失去电子生成氮气;硫元素化合价降低,得到电子生成二氧化硫;3mol (NH4)2SO4分解3molSO2,得电子6mol。
硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:
已知:Ksp(Ag2S04)=1.4×10-5,请回答下列问题:
14.“加硫酸并焙烧”时的硫酸浓度最好为 (填字母)。
a.浓硫酸
b.10%硫酸
15.“加硫酸并焙烧”过程中Cu2Se参与反应的化学方程式为____________,该反应的还原剂是 。
16.“炉渣加水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是 ,“浸渣”中含有的金属成分是 ,若“浸出液”中c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为 (计算结果保留2位有效数字)。
17.操作I的名称为 。
18.+4价Se的氧化性强于+ 4价S的氧化性,SeO2、SO2混合气体用水吸收所发生反应的化学方程式为 。
19.操作I所得粗硒中含有Ni、Fe、Cu等杂质,可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
蒸馏操作中控制的最佳温度是 (填字母)。
a.455℃
b.462℃
c.475℃
d.515℃
正确答案
a
解析
将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,故选a;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
Cu2Se+6H2SO4(浓)
解析
加硫酸并焙烧”过程中Cu2Se与浓硫酸反应,参与反应的化学方程式为
Cu2Se+6H2SO4(浓)
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
加快浸出速率 Au、Pt 1.6×10-2 moL/L
解析
“炉渣加水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是增大接触面积,加快浸出速率,金属银能和热的浓硫酸反应,“浸渣”中含有的金属成分是金、铂,若“浸出液”中c(Ag+)=3.0×10-2 mol/L,根据Ksp(Ag2S04)=1.4×10-5,(3.0×10-2)2×c(SO42-)=1.4×10-5,则溶液中c(SO42-)最大为1.6×10-2 moL/L;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
过滤
解析
将固液分开,操作I的名称为过滤;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
SeO2+2SO2+2H2O=2H2SO4+Se↓
解析
+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸,混合气体用水吸收所发生反应的化学方程式为:SeO2+2SO2+2H2O=2H2SO4+Se↓;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
c
解析
由图可知475℃左右蒸馏的挥发物中硒含量最高,故选c。
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
氯化铝为共价化合物,熔点、沸点都很低,且会升华,极易潮解,遇水放热并产生白色烟雾。请回答下列问题:
20.甲组同学按照如图一所示装置,通过实验制备A1Cl3固体。装置B中滴入浓硫酸后发生的反应为2NaCl+H2SO4(浓)
①向装置B中滴加浓硫酸;
②点燃B处酒精灯;
③点燃D处酒精灯。这三项操作的正确顺序为 (填序号)。
21.乙组同学认为甲组同学的装置设计存在不安全因素,因此乙组同学对甲组同学所设计的装置D、E进行了改进(如图二所示),装置E改为带支管的烧瓶,该烧瓶的名称为 ,改进后的优点是 。
22.设计实验证明:
①AlCl3能够水解: 。
②AlCl3是共价化合物: 。
正确答案
浓硫酸 2Al+6HCl(g)=2AlC13+3H2 防止空气中的水蒸气进入装置E ①②③
解析
装置B中滴入浓硫酸后发生的反应为2NaCl+H2SO4(浓)
考查方向
解题思路
装置B中滴入浓硫酸后发生的反应为2NaCl+H2SO4(浓)
易错点
注意凝华的AlC13可能堵塞D、E之间的导气管。
正确答案
蒸馏烧瓶 防止凝华的AlC13堵塞D、E之间的导气管
解析
凝华的AlC13可能堵塞D、E之间的导气管,因此乙组同学对甲组同学所设计的装置D、E进行了改进(如图二所示),装置E改为带支管的烧瓶,该烧瓶的名称为蒸馏烧瓶,改进后的优点是生成物直接进入蒸馏烧瓶,防止凝华的AlC13堵塞D、E之间的导气管;
考查方向
解题思路
凝华的AlC13可能堵塞D、E之间的导气管,因此乙组同学对甲组同学所设计的装置D、E进行了改进(如图二所示),装置E改为带支管的烧瓶,该烧瓶的名称为蒸馏烧瓶,改进后的优点是生成物直接进入蒸馏烧瓶,防止凝华的AlC13堵塞D、E之间的导气管;
易错点
注意凝华的AlC13可能堵塞D、E之间的导气管。
正确答案
①取少量AlCl3溶液,用pH试纸测其pH,pH<7 ②做AlC13熔融状态下的导电实验
解析
①取少量AlCl3溶液,用pH试纸测其pH,pH<7,能证明AlCl3能够水解;
②做AlC13熔融状态下的导电实验,AlC13熔融状态下不导电,因此AlCl3是共价化合物。
考查方向
解题思路
①取少量AlCl3溶液,用pH试纸测其pH,pH<7;
②AlC13熔融状态下不导电。
易错点
注意凝华的AlC13可能堵塞D、E之间的导气管。
12.某同学做如下实验:
下列说法正确的是
正确答案
解析
对比两个盐桥的双液装置,图1 中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等。图2 中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极发生的反应是 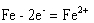
考查方向
本题主要考查了原电池
解题思路
对比两个盐桥的双液装置,图1 中发生的是普通的化学腐蚀,且腐蚀速率相等。图2 中发生的是电化学腐蚀可以用
易错点
知识点
扫码查看完整答案与解析