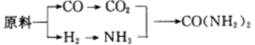- 卤素原子结构及其性质的比较
- 共92题
13.葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是( )
正确答案
解析
A.亚硫酸根离子具有强的还原性,易被氧气氧化为稳定的硫酸盐,所以亚硫
酸盐可作为食品添加剂,防腐保鲜,因此葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用
了亚硫酸盐的还原性,所以A正确;
B.亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,氮气和二氧化硫之间不会反应,反应①中通入N2可以将生成的气体二氧化硫全部赶出,所以通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出,B正确;
C.若试剂A选择氯水,通过N2将产生的SO2气体完全吹出后用氯水吸收,NaOH标准液标定时,过量的氯水会对实验结果产生影响,使得消耗更多的NaOH标准液,所以测定结果会偏大,C错误;
D.若试剂A选择碱液,调节吸收后溶液为中性,由于SO32->I-,所以溶液中Na2SO3及NaHSO3中的SO32-均可以与I2反应,所以试剂B可选择I2标准液可以准确测定SO32-的含量,进而确定SO2的含量,D正确。
考查方向
本题以工业流程转化关系呈现,以葡萄酒样品中的亚硫酸盐含量的测定为问题情境,通过简明的实验流程图,将氧化还原的规律及其氧化还原滴定、酸碱中和滴定的实验原理等内容综合在一起,考查考生对化学实际问题的分析和解决能力。
解题思路
A.亚硫酸根离子具有强的还原性,易被氧气氧化为稳定的硫酸盐,所以亚硫
酸盐可作为食品添加剂,防腐保鲜,因此葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用
了亚硫酸盐的还原性;
B.亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,氮气和二氧化硫之间不会反应,反应①中通入N2可以将生成的气体二氧化硫全部赶出;
C.若试剂A选择氯水,通过N2将产生的SO2气体完全吹出后用氯水吸收,NaOH标准液标定时,过量的氯水会对实验结果产生影响,
D.若试剂A选择碱液,调节吸收后溶液为中性,由于SO32->I-,所以溶液中Na2SO3及NaHSO3中的SO32-均可以与I2反应,所以试剂B可选择I2标准液。
易错点
通过N2将产生的SO2气体完全吹出后用氯水吸收,NaOH标准液标定时,过量的氯水会对实验结果产生影响。
知识点
4.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
正确答案
解析
单质的氧化性越强,其元素的非金属性越强,可以判断非金属性强弱,故A不选;
单质的沸点属于物理性质,与元素的非金属性无关,不能判断非金属性强弱,故B选;
单质与氢气化合越容易,则元素的非金属性越强,可以判断非金属性强弱,故C不选;
最高价氧化物对应的水化物酸性越强,其元素的非金属性越强,可以判断非金属性强弱,故D不选.
考查方向
解题思路
比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱.
易错点
本题考查非金属性的比较,题目难度不大,注意元素非金属性和金属性的比较角度,学习中注意相关基础知识的积累.
知识点
4.已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2 +I- 
正确答案
解析
A.依据操作的化学平衡分析可知,测定的是I2和I3-的含量,不能准确测定溶液中的c(I2),所以A错误;
B.淀粉可以做滴定反应I2+2Na2S203=2NaI + Na2S406 的指示剂,但是依据操作的化学平衡分析可知,测定的是I2和I3-的含量,不能准确测定溶液中的c(I2),所以B错误;
C.依据化学平衡可知,实验只能测得溶液中c(I2)与c(I3-)之和,所以C正确;
D.I-不能与Na2S203溶液反应,所以D错误。
考查方向
解题思路
碘单质能与I- 反应成I3-,并在溶液中建立如下平衡:I2 +I- 
A.依据操作的化学平衡分析可知,测定的是I2和I3-的含量,不能准确测定溶液中的c(I2);
B.淀粉可以做滴定反应I2+2Na2S203=2NaI + Na2S406 的指示剂,但是依据操作的化学平衡分析可知,测定的是I2和I3-的含量,不能准确测定溶液中的c(I2);
C.依据化学平衡可知,实验只能测得溶液中c(I2)与c(I3-)之和;
D.I-不能与Na2S203溶液反应
易错点
不能准确化学平衡对物质浓度的影响,用Na2S203 溶液进行滴定I2时,随着反应的进行,化学平衡I2 +I- 
知识点
卤族元素的单质能与H2反应
用电子式表示HCl的形成过程________。
依据上表,可以推测出:随着原子序数的递增,________(填字母)
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式________。
卤族元素位于周期表中的________族。
正确答案
解析
考查方向
解题思路
根据表格所给实验事实,判断卤素非金属强弱并结合题目所给信息进行思考
易错点
卤素非金属性强弱的宏观判据和微观实质易混淆
正确答案
bd
解析
根据表格可知卤素非金属性由上至下依次减弱,所以选 bd
考查方向
解题思路
根据表格所给实验事实,判断卤素非金属强弱并结合题目所给信息进行思考
易错点
卤素非金属性强弱的宏观判据和微观实质易混淆
正确答案
BrCl + SO2 + 2H2O = H2SO4 +HCl +HBr
解析
模拟氯气与二氧化硫的反应写出 BrCl + SO2 + 2H2O = H2SO4 +HCl +HBr
考查方向
解题思路
根据表格所给实验事实,判断卤素非金属强弱并结合题目所给信息进行思考
易错点

正确答案
ⅦA
解析
卤素位于周期表ⅦA
考查方向
本题考查元素化合物中卤素的知识和元素周期律同时考查了化学用语的知识,能力角度主要考查了信息的认识和使用。
解题思路
根据表格所给实验事实,判断卤素非金属强弱并结合题目所给信息进行思考
易错点
卤素非金属性强弱的宏观判据和微观实质易混淆
研究化肥的合成、废水的处理等有现实的重要意义。
29.硝酸铵的生产方法是采用硝酸与氨气化合,工业合成氨是一个放热反应,因此低温有利于提高原料的转化率,但实际生产中却采用400~500℃的高温,其原因是 ;工业生产中,以氨气为原料合成硝酸,写出工业生产硝酸的最后一步的化学方程式________________。
30.甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
已知:CO+H2O
①甲厂以焦炭和水为原料; ②乙厂以天然气和水为原料;
③丙厂以石脑油(主要成分为C5H12)和水为原料。
按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?_____________________。
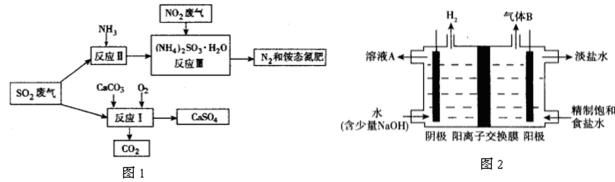
31.将工厂废气中产生的SO2通过下列流程如图1,可以转化为有应用价值的硫酸钙等。
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________ 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42﹣所用试剂是_______________________。
32.工业上利用氯碱工业产品治理含二氧化硫的废气。图2是氯碱工业中电解饱和食盐水的原理示意图。
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是____________________ 。
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_________________ 。
正确答案
催化剂的催化活性较强,反应速率快 3NO2+H2O=2HNO3+NO
解析
高温尽管不利于氨的生成,但在400~500 ℃下催化剂的活性较大,可以提高反应速率,用氨气合成硝酸通过氨的催化氧化生成一氧化氮,一氧化氮与O2反应生成二氧化氮,然后用水与二氧化氮反应可生成硝酸三个阶段。
考查方向
解题思路
根据题意求出解析
易错点
实验评价思路不清
正确答案
丙
解析
甲、乙、丙的主要反应分别为C+H2O(g) 


考查方向
解题思路
根据题意求出解析
易错点
实验评价思路不清
正确答案
①2CaCO3+O2+2SO2=2CaSO4+2CO2
②防止亚硫酸铵被氧化
③盐酸和氯化钡(HCl和BaCl2)
解析
①根据反应物和生成物,可写出反应Ⅰ的化学方程式。②加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵被氧化。③检验硫酸根离子用盐酸和氯化钡,看有无白色沉淀。
考查方向
解题思路
根据题意求出解析
易错点
实验评价思路不清
正确答案
SO2+2OH﹣=SO32﹣+H2O(或SO2+OH﹣=HSO3﹣)
SO2+Cl2+H2O=4H++SO42﹣+2Cl﹣
解析
(4)①二氧化硫和氢氧化钠反应生成亚硫酸氢钠。②阳极区产生的气体为氯气,与二氧化硫反应生成硫酸和盐酸。
(1)高温尽管不利于氨的生成,但在此温度下催化剂的活性较大,可以提高反应速率,用氨气合成硝酸通过了氨气氧化生成一氧化氮,一氧化氮生成二氧化氮,然后用水与二氧化氮反应生成硝酸的三个阶段。
(2)甲、乙、丙的主要反应分别为:C+H2O(g) 
(3)①根据反应物和生成物,写成反应Ⅰ的化学方程式。②加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵被氧化。③检验硫酸根离子用盐酸和氯化钡,看有无白色沉淀。
(4)①二氧化硫和氢氧化钠反应生成亚硫酸氢钠。②阳极区产生的气体为氯气,与二氧化硫反应生成硫酸和盐酸。
考查方向
解题思路
根据题意求出解析
易错点
实验评价思路不清
扫码查看完整答案与解析