- 卤素原子结构及其性质的比较
- 共92题
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要。
石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示。
18.则12g石墨烯中含有 个6元环。
19.工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
20.苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g) 

当反应进行到30 min时恰好到达平衡,则n2取值的最小范围是________;
改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为 。
21.用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH]。葡萄糖酸在 极生成,对应的电极反应式 。
正确答案
0.5NA
解析
:一个碳原子参与三个碳的形成,所以形成一个六元环,需要碳原子的个数为:6×1/3=2,所以12g石墨烯物质的量为1mol,所以形成6元环的物质的量为:1/2mol,即0.5NA个6元环,故答案为:0.5NA;
考查方向
解题思路
】一个碳原子参与三个碳的形成,所以形成一个六元环,需要碳原子的个数为:6×1/3=2,由此分析解答;
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
正确答案
解析
①CH4+0.5O2(g)⇌CH3OH(g)△H=-128.5kJ/mol,正反应是气体体积减少的反应,所以可以通增大压强、选用合适的催化剂,故答案为:增大压强、选用合适的催化剂;②由CH4+0.5O2(g)⇌CH3OH(g)△H=-128.5kJ/mol…Ⅰ,CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol…Ⅱ,目标反应CH3OH(g)+0.5O2(g)→HCHO(g)+H2O(g),得Ⅱ-Ⅰ得:CH3OH(g)+0.5O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1,故答案为:CH3OH(g)+0.5O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1;
考查方向
解题思路
】①可以从加快化学反应速率和平衡移动的角度分析解答;②根据盖斯定律分析求解;
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
正确答案
0.22
解析
①平衡时的量比20min的量小,但变化量小于10min-20min,所以0.22<n<0.26,故答案为:0.22<n<0.26;②C8H10(g)⇌C8H8(g)+H2(g)
开始 0.40mol 0 0
变化 x x x
平衡0.40mol-x x x
所以:0.4+x/0.4=1.4,解之得:x=0.16,所以苯乙烷的转化率为0.16/0.4×100%=40%,故答案为:40%;
考查方向
解题思路
】①平衡时的量比20min的量小,但变化量小于10min-20min,所以0.22<n<0.26;②根据三行式求变化量;
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
正确答案
阳 CH2OH(CHOH)4CHO+H2O-2e-== CH2OH(CHOH)4COOH+2H+(2分)
解析
葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]发生氧化反应,所以在阳极产生,电极反应式为:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+;故答案为:阳;CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
考查方向
解题思路
】葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]发生氧化反应,所以在阳极产生,电极反应式为:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质。工业上利用软锰矿制取碳酸锰(MnCO3)流程如下:
其中,还原焙烧主反应为:2MnO2+C=2MnO+CO2↑。根据要求回答问题:
14.步骤D中Fe2+被氧化,该反应的离子方程式为 。
15.步骤H的离子方程式为 。
16.加入Na2S可以除去Pb2+、Al3+等离子。已知Ksp(PbS)=1×10-28 Ksp(MnS)= 1×10-9.6 ,当溶液中c(Pb2+)=1×10-5mol·L-1时,溶液中c(Mn2+)允许的最大值为 。
17.pH=0的溶液中,不同价态锰的微粒的能量(△G)如右图。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。
MnO42—能否稳定存在于pH=0的溶液中?
答:______________(“能”或“不能”);
将Mn3+歧化反应设计为原电池,可测定反应平衡常数。
电池负极反应为 ,平衡常数表达式为 ;
实验室可利用以下反应检验Mn2+存在:
2Mn2+ + 5S2O82- + 8H2O → 16H+ + 10SO42- + 2MnO4-
确认Mn2+存在的现象是 ;检验时必须控制Mn2+浓度和用量不能过大,否则实验失败。理由是 。
正确答案
2Fe2++MnO2+4H+==2Fe2++Mn2++2H2O
解析
步骤D中酸性溶液中Fe2+被MnO2氧化为铁离子,二氧化锰被还原生成锰离子,反应的离子方程式为:2Fe2++MnO2+4H+═2Fe2++Mn2++2H2O,故答案为:2Fe2++MnO2+4H+═2Fe2++Mn2++2H2O;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,步骤D中酸性溶液中Fe2+被MnO2氧化为铁离子,二氧化锰被还原生成锰离子;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
正确答案
Mn2++2HCO3—= MnCO3↓+CO2↑+H2O
解析
步骤H是硫酸锰和碳酸氢铵反应,碳酸氢根离子过量,所以锰离子结合碳酸根离子生成碳酸锰沉淀,氢离子浓度增大和过量的碳酸氢根离子反应生成二氧化碳气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,步骤H是硫酸锰和碳酸氢铵反应,碳酸氢根离子过量,所以锰离子结合碳酸根离子生成碳酸锰沉淀,氢离子浓度增大和过量的碳酸氢根离子反应生成二氧化碳气体;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
正确答案
1×1013.4 mol·L-1
解析
已知Ksp(PbS)=1×10-28,当溶液中c(Pb2+)=1×10-5mol•L-1时,c(S2-)=1×10−28/1×10−5
=10-23mol/L,Ksp(MnS)=1×10-9.6,溶液中c(Mn2+)允许的最大值=1×10−9.6/10−23=1×1013.4 mol•L-1,
故答案为:1×1013.4 mol•L-1;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,当溶液中c(Pb2+)=1×10-5mol•L-1时沉淀完全,计算硫离子浓度,结合硫化锰溶度积计算锰离子的最大浓度;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
正确答案
①不能 ② Mn3++2H2O-e- =MnO2+4H+ K=c(Mn2+)·c4(H+)/c2(Mn3+)③溶液呈紫红色 过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察
解析
若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒,则依据图象分析判断,MnO42-在MnO4-和MnO2之间;将Mn3+歧化反应得到Mn2+和MnO2,2Mn3++2H2O=MnO2+Mn2++4H+,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;MnO4-溶液中呈紫红色,检验时必须控制Mn2+浓度和用量不能过大过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,①若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒,则依据图象分析判断,MnO42-在MnO4-和MnO2之间;②将Mn3+歧化反应得到Mn2+和MnO2,2Mn3++2H2O=MnO2+Mn2++4H+,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;③MnO4-溶液中呈紫红色,检验时必须控制Mn2+浓度和用量不能过大过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
某实验研究小组欲检验草酸晶体分解的产物并测定其纯度(杂质不发生反应)。查阅资
料:草酸晶体( H2C204·2H20) l00℃开始失水,101. 5C熔化,150℃左右分解产生H2O、CO和
C02。下面是可供选择的实验仪器(图中某些加热装置已略去),实验所需药品不限。
8. 最适宜加热分解革酸晶体的装置是C。若选装置A可能会造成的后果是 ;
若选装置B可能会造成的后果是 。
9.三种气体检验的先后次序是____(填编号)。
A. CO2 、H2O、CO
B.CO、H2O、CO2
C.H2O、CO2、CO
D.H2O、CO、CO2
10.实验利用装置“G(碱石灰)-F-D(CuO固体)-F”检验CO,则F中盛装的试剂是
__ _,证明含有CO的现象是 ____。
11.把分解装置与装有NaOH溶液的E装置直接组合,测量完全分解后所得气体的体积,
测定ag草酸晶体的纯度。经实验得到气体的体积为V mL(已换算成标准状况),则草酸
纯度的表达式为____ 。
12.请设计实验方案测量草酸二级电离平衡常数Ka2的值: ____,并根据方案中测得的物理量,写出计算Ka2的表达式 。
正确答案
固体药品熔化后会流到试管口
冷凝水会倒流到试管底,造成试管破裂
解析
最适宜加热分解革酸晶体的装置是C.若选装置A可能会造成的后果是固体药品熔化后会流到试管口,若选装置B可能会造成的后果是冷凝水会倒流到试管底,造成试管破裂。
故答案为:固体药品熔化后会流到试管口;冷凝水会倒流到试管底,造成试管破裂
考查方向
解题思路
草酸晶体的熔点低,受热容易熔化,用C装置加热分解革酸晶体,熔融的固体不易流下,适用于加热草酸,若选择装置A加热会使固体熔融物溶化后流到试管口处,若选择装置B分解生成的水会倒流试管底部炸裂试管。
易错点
电离平衡常数掌握不熟
正确答案
C
解析
150℃左右分解产生H2O、CO和C02,三种气体的检验顺序应遵循现象明显且不相互干扰,应先检验水,再检验二氧化碳,最后检验一氧化碳。
故答案为:C
考查方向
解题思路
150℃左右分解产生H2O、CO和C02,三种气体的检验顺序应遵循现象明显且不相互干扰,应先检验水,再检验二氧化碳,最后检验一氧化碳。
易错点
电离平衡常数掌握不熟
正确答案
澄清的石灰水
前一个F中没有浑浊,后一个F中有沉淀;D中固体反应后从黑色变成红色。
解析
实验利用装置“G(碱石灰)﹣F﹣D(CuO固体)﹣F”检验CO,通过装置G吸收水和二氧化碳,通过装置F检验二氧化碳是否除净,通过装置D检验是否有一氧化碳含有氧化铜为铜,最后通过装置F检验是否生成二氧化碳气体。
故答案为:澄清的石灰水;前一个F中没有浑浊,后一个F中有沉淀,D中固体反应后从黑色变成红色
考查方向
解题思路
实验利用装置“G(碱石灰)﹣F﹣D(CuO固体)﹣F”检验CO,通过装置G吸收水和二氧化碳,通过装置F检验二氧化碳是否除净,通过装置D检验是否有一氧化碳含有氧化铜为铜,最后通过装置F检验是否生成二氧化碳气体。
易错点
电离平衡常数掌握不熟
正确答案
解析
反应的化学方程式为:H2C2042H203H2O+CO+C02,实验得到气体的体积为VmL(已换算成标准状况),为一氧化碳,物质的量和草酸晶体物质的量相同,n(H2C2042H20)=n(CO)=mol/L,
草酸纯度的表达式=
故答案为:
考查方向
解题思路
草酸晶体(H2C2042H20)l00℃开始失水,101.5C熔化,150℃左右分解产生H2O、CO和C02.反应的化学方程式为:H2C2042H203H2O+CO+C02,实验得到气体的体积为VmL(已换算成标准状况),为一氧化碳,物质的量和草酸晶体物质的量相同,据此计算。
易错点
电离平衡常数掌握不熟
正确答案
常温时,用pH计测量0.100 mol/L 草酸钠溶液的pH,则c(OH-)=Kw/c(H+)
依据 C2O42-+H2O
或

解析
常温时,用pH计测量0.100mol/L草酸钠溶液的pH,则c(OH-)=Kw/c(H+)
依据 C2O42-+H2O
或

考查方向
解题思路
常温时,用pH计测量0.100mol/L草酸钠溶液的pH,依据水解平衡C2O42﹣+H2O?HC2O4﹣+OH﹣,计算平衡常数。
易错点
电离平衡常数掌握不熟
6.下列实验操作、现象与结论对应关系正确的是( )
正确答案
解析
A项酸性条件下NO3—被Fe2+还原为NO,B项含有酚酞的Na2CO3溶液,因碳酸根离子水解显碱性溶液变红,加入少量BaC12固体,水解平衡逆向移动,则溶液颜色变浅,证明Na2CO3溶液中存在水解平衡,故B正确;C项由于起始时,HX、HY等体积等PH值,HX放出的氢气多且反应速率快,说明HX浓度比HY大, 即HX酸性比HY弱,该选项错误。D.等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大,可比较亚硫酸与碳酸的酸性,因亚硫酸不是最高价含氧酸,则不能比较非金属性的强弱,故D错误
考查方向
解题思路
对操作与实现合理分析,每一结论与现象是否吻合。
易错点
等体积,等PH的两酸,是越弱反应速度越快。
知识点
【化学选修——化学与生活】
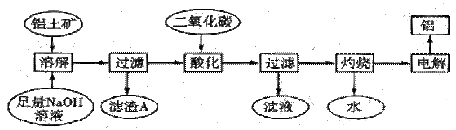
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为: 2Na2SiO3+2NaAlO2+4H2O=Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
21.溶解铝土矿时,发生反应的离子方程式为 、 ________。
22.滤渣A的主要成分是 ;硅铝酸盐沉淀写成氧化物的形式是 。
23.在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 。
24.若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 。
25.若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
26.电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 ,配位数为 。
正确答案
2OH-+Al2O3=2AlO2-+H2O
SiO2+2OH-=SiO32-+H2O
解析
铝土矿中氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,离子方程式:2OH﹣+Al2O3═2AlO2﹣+H2O;
二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH﹣═SiO32﹣+H2O
考查方向
解题思路
铝土矿中氧化铝、二氧化硅能够与氢氧化钠反应
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
Fe2O3、Na2Al2Si2O8
Na2O·Al2O3.·2SiO2
解析
依据铝土矿主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,铝土矿中氧化铝、二氧化硅能够与氢氧化钠反应分别生成偏铝酸钠和硅酸钠,氧化铁不与氢氧化钠反应,依据2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物,所以Na2Al2Si2O8改写为氧化物为Na2O•Al2O3•2SiO2
考查方向
解题思路
依据铝土矿主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,结合氧化铝、二氧化硅性质判断滤渣成分;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率(或合理答案)
解析
反应后溶液含有大量偏铝酸钠溶液,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,若选用盐酸,则生成的氢氧化铝会溶于过量的盐酸,所以第三步中选用二氧化碳作酸化剂。
考查方向
解题思路
依据氢氧化铝能够溶于强酸,不溶液弱酸的性质解答。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
5100n/27m% 或1700n/9m%
解析
设铝土矿中氧化铝为xkg,
2Al~~~~Al2O3
27×2 102
nkg xkg
则x=
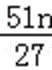
铝土矿中Al2O3的质量分数为
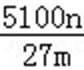
考查方向
解题思路
根据铝元素守恒由Al的质量计算出氧化铝的质量,再求出质量分数。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
B
解析
浓硫酸、浓硝酸具有强的氧化性,能够使铝钝化,不能用来溶解铝,铝与稀硝酸反应生成硝酸铝和一氧化氮和水,一氧化氮有毒,铝与稀硫酸反应生成硫酸铝和氢气,可以用来溶解铝,故选B
考查方向
解题思路
浓硫酸、浓硝酸具有强的氧化性,能够使铝钝化,铝与稀硝酸反应生成硝酸铝和一氧化氮和水,与稀硫酸反应生成硫酸铝和氢气。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
[AlF6]3-
6
解析
中心离子和配体组成內界,其余部分为外界,则Na3AlF6中Na+为外界,[AlF6]3-为內界;配原子的数目即是配位数,所以配位数为6
考查方向
解题思路
中心离子和配体组成內界,其余部分为外界;配原子的数目即是配位数。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
扫码查看完整答案与解析