- 化学科学特点
- 共348题
1.化学与日常生活密切相关,下列物质的使用不涉及化学变化的是
正确答案
解析
A.液氨用作制冷剂,是利用了液氨易汽化吸热这一物理性质,故错误。
B.明矾溶于水后电离出的Al3+因水解形成胶体具有吸附性达到净化水的目的是化学变化过程。
C.石英的主要成分是SiO2,不与酸反应除氢氟酸,所以可以用用以石英(玻璃)雕刻。
D.在常温下浓硝酸与铁、铝金属发生钝化,因此可以采用铁质容器盛放,钝化是化学变化。
考查方向
解题思路
本题主要应用基本的化学知识:物质性质、基本原理,明确化学反应与物理变化的区别
易错点
物理变化与化学变化的区别
知识点
1.“保护环境”是我国的基本国策。下列做法不应该提倡的是( )
正确答案
解析
A.采取低碳、节俭的生活方式,节省大量的能源,符合保护环境的措施,故A不选;B.垃圾分类有利于环境的保护和资源的再利用,符合保护环境的措施,故B不选;C.深入农村和社区宣传环保知识,树立保护环境从自我做起、保护环境人人有责的意识,符合保护环境的措施,故C不选;D.经常使用一次性筷子和纸杯,会消耗大量的木材,一次性塑料袋的大量使用会造成白色污染,故措施不合理,故D选;
故选D.
考查方向
解题思路
保护环境,可从减少污染物的排放、开发新能源等角度分析.
易错点
本题主要考查环境保护,注意保护环境人人有责,从自我做起,从小事做起,明确环境和人类发展的关系及环境保护意识即可解答,题目难度不大.
知识点
7.下列关于化工生产的叙述中,符合目前工业生产实际的是( )
正确答案
解析
A.石油工业中,利用馏分沸点不同,采用蒸馏的方法把石油分成不同沸点范围的产品,A错误;
B.硝酸工业中,不使用能被硝酸腐蚀的铁触媒作催化剂,B错误;
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率,C正确;
D.改变压强,平衡常数不变,D错误。
故选C。
考查方向
解题思路
A.石油工业中,利用馏分沸点不同,采用蒸馏的方法把石油分成不同沸点范围的产品;
B.铁触媒作催化剂能被硝酸腐蚀;
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率;
D.改变压强,平衡常数不变。
易错点
解题的关键是注意硝酸工业中,不使用能被硝酸腐蚀的铁触媒作催化剂。
知识点
发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
21.将煤转化成水煤气的反应:C(s)+H2O(g) 
22.CO2制备甲醇:CO2(g)+3H2(g)
在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g) 和CH3OH(g) 浓度随时间变化如右图所示。
① 该反应化学平衡常数K的表达式是________。
② 0~9min时间内,该反应的平均反应速率ν(H2) =________。
③ 在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0 < Q < 29.5
b. 29.5 < Q < 36.75
c.36.75 < Q < 49
d. 49 < Q < 98
④ 在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X 分别表示温度或压强。
i. X表示的物理量是 。
ii. 判断L1与L2的大小关系,并简述理由: 。
23.利用铜基催化剂光照条件下由CO2和H2O制备CH3OH的装置示意图如下图所示,该装置工作时H+移向 极(填“a”或“b”),阴极的电极反应式是 。
正确答案
不变 加入催化剂后反应物和生成物的总能量不变
解析
加入催化剂后,不能改变反应物和生成物的总能量,所以△H不变,故答案为不变;加入催化剂后反应物和生成物的总能量不变。
考查方向
解题思路
加入催化剂后,不能改变反应物和生成物的总能量;
易错点
1、电极方程式书写。
2、外界条件对平衡的影响。
正确答案
① K =
② 0.25 mol•L-1•min-1
③ c
④ i.温度 ii.L1>L2 温度一定时,增大压强,CO2平衡转化率增大
解析
①CO2(g)+3H2(g)


②由图中可知,△c (CH3OH)=0.75mol/L,则△c (H2)=3△c (CH3OH)=0.75mol/L *3=2.25mol/L,则V(H2)=△c/t=2.25/9=0.25 mol·L-1·min-1,故答案为 0.25 mol·L-1·min-1;
③当体积为1L时,△n(CH3OH)=0.75mol,由 CO2(g)+3H2(g)
④ i、由图可知,随着X的增大,CO2的平衡转化率是减小的,由方程式CO2(g)+3H2(g)
考查方向
解题思路
①CO2(g)+3H2(g)
②由图中可知,△c (CH3OH)=0.75mol/L,则△c (H2)=3△c (CH3OH)=0.75mol/L *3=2.25mol/L,则V(H2)=△c/t=2.25/9=0.25 mol·L-1·min-1
③当体积为1L时,△n(CH3OH)=0.75mol,由 CO2(g)+3H2(g)
④ i、由图可知,随着X的增大,CO2的平衡转化率是减小的;
易错点
1、电极方程式书写。
2、外界条件对平衡的影响。
正确答案
①a
②CO2 + 6H+ + 6e- == CH3OH + H2O
解析
由图可知,装置为电解池,a为阴极,b为阳极,则H+应向阴极a的方向移动,阴极发生的反应为甲醇在酸性条件下得电子生成二氧化碳,电极反应式为CO2 + 6H+ + 6e- == CH3OH + H2O,故答案为① a ② CO2 + 6H+ + 6e- == CH3OH + H2O;
考查方向
解题思路
由图可知,装置为电解池,a为阴极,b为阳极
易错点
1、电极方程式书写。
2、外界条件对平衡的影响。
1.化学与人类生产、生活密切相关,下列说法正确的是
正确答案
解析
有机玻璃的主要成分是有机高分子化合物(聚甲基丙烯酸甲酯),而生活中最常见的玻璃的主要成分是SiO2、Na2SiO3等,A答案说的是有机玻璃,有机玻璃不是硅酸盐材料,所以A错;煤的气化是C(碳)与水蒸气反应的到气体燃料,煤的液化是煤与H2在催化剂条件下发生反应转化为液体燃料。煤的气化和液化都属于化学变化,所以B错;纯银器在空气中变黑是因为和空气中的氧气等发生化学反应,银与氧气反应属于化学腐蚀,不属于电化学腐蚀,所以C错;硫酸亚铁中的铁显+2价,Fe2+易被氧化成为Fe3+,而缺铁性贫血是由于人体中缺乏Fe2+,维生素C具有还原性,可以防止Fe2+易被氧化成为Fe3+,所以本题选D
考查方向
解题思路
区别概念,加深理解和记忆。1、有机玻璃的主要成分是有机高分子化合物(聚甲基丙烯酸甲酯),普通玻璃的主要成分是SiO2、Na2SiO3等。煤的气化是煤与水蒸气发生化学反应。化学腐蚀是物质直接发生化学反应,而电化学腐蚀会在金属表面形成微小的原电池。维生素C具有还原性,可防止物质被氧化。
易错点
此题比较简单,很多内容也是教材中原话,错误在于1、对于某些物质的成分没有理解,对于玻璃和有机玻璃混为一谈,概念上区分不清;2、物理变化与化学变化的概念理解不清楚,对于煤的气化和液化的概念及过程记忆不够深;3、对电化学腐蚀和化学腐蚀理解透彻,本题的C答案就可以排除掉。本题如果选错,错就错在有些概念上没有理解,将自己的想法强加于此题
知识点
2.下列物质反应后,固体质量减轻的是
正确答案
解析
3Fe+4H2O(g)=Fe3O4+4H2,Fe3O4的相对分子质量大于Fe的,所以是质量增大的反应,所以A错;2CO2+2Na2O2=2Na2CO3+O2,Na2CO3的相对分子质量是106,,Na2O2的相对分子质量是78,反应前的相对分子质量比较小,反应后的相随分子质量增大,所以B错;Zn+CuSO4=ZnSO4+Cu,CuSO4、ZnSO4使溶质存在于溶液中不是固体,所以由Zn(相对原子质量是65)变为Cu(相对原子质量是64)是质量减小的反应,所以C正确;D选项中反应前后都是固体,没有出现气体或是液体,根据质量守恒定律,其反应前后的质量不变
考查方向
解题思路
首先写出四个选项中的化学反应方程式,观察化学反应前后的物质的状态,此题主要说的是固体质量的变化,所以本题中出现的所有的气体和液体都可以排除点,然后观察化学反应前的固体的相对分子质量和反应后固体的相对分子质量,前后比较,反应物固体的相对分子质量大,反应后生成物的相对分子质量小,就是本体的答案了。
易错点
不会写化学反应方程式,对反应前后的物质变化分析不清楚,对元素守恒定律理解不清。
知识点
开发新能源是解决环境污染的重要举措,工业常用CH4与CO2反应制备H2和CO,再H2和CO利用合成甲醇。
26. 已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1274.0KJ/mol
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0KJ/mol
③ H2O(g)=H2O(l) △H3=-44KJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
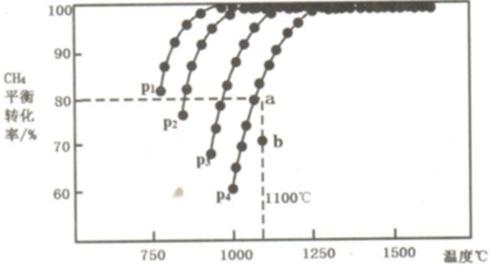
27.在恒容密闭容器中通入CH4与CO2,使其物质的量浓度为1.0mol/L,在一定条件下发生反应:CO2(g) + CH4(g) 
则:①该反应的△H 0(填“<、= 或>”);
②压强P1、P2、P3、P4由大到小的关系为 。压强为P4时,在b点:v(正) v(逆)。(填“<、= 或>”)
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp= ;如果P4=0.36MPa,求a点的平衡常数Kp= ;(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
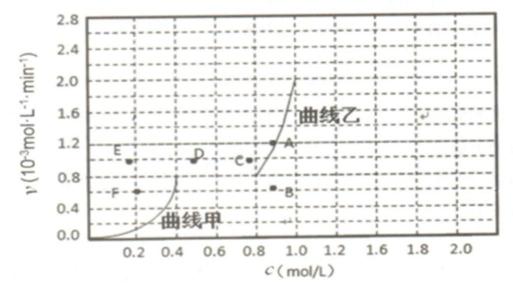
④为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度 关系曲线:v正~c(CH4)和v逆~c(CO)。
则:ⅰ)与曲线v正~c(CH4)相对应的是上图中曲线 (填“甲”或“乙”)。
ⅱ)当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为 (填字母)。
正确答案
CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
解析
根据盖斯定律可以求出该反应的热化学方程式为:CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
考查方向
解题思路
根据盖斯定律可以求出该反应的热化学方程式为:CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
易错点
读图分析反应平衡移动的方向。
正确答案
① >; ② p4> p3> p2 >p1 ;>
③ P2(CO)·P2(H2)/(P(CO2) ·P(CH4)) ;1.64(MPa)2
④ i)乙 ; ii)B F
解析
①由图可知,温度升高甲烷的平衡转
②由该反应式可知,增大压强有助于反应向逆反应方向进行,所以从P1到P4压强依次增大,由图可知此时该反应还在向正反应方向进行着,所以正反应速率大于逆反应速率。
③以气体压强表示气体的浓度则平衡常数为:P2(CO)·P2(H2)/(P(CO2) ·P(CH4))
④由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速,所以乙曲线对应甲烷的反应速率曲线。
考查方向
解题思路
①由图可知,温度升高甲烷的平衡转
②由该反应式可知,增大压强有助于反应向逆反应方向进行。
④由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速。
易错点
读图分析反应平衡移动的方向。
7.化学与材料、生活和环境密切相关。下列有关说法中错误的是()
正确答案
解析
铁粉是抗氧化剂,A项错误;脱硝技术能减少污染,B项正确;明矾水解产生氢氧化铝胶体,可以净水,但不能杀菌消毒,C项正确;碳化硅、陶瓷和碳纤维都是一种新型无机非金属材料,D正确。
考查方向
解题思路
理清生活中常见添加剂和常见物质的化学本质。
易错点
误认为铁粉可以做干燥剂,明矾可以杀菌消毒。
知识点
7.化学与生产、生活密切相关。下列说法不正确的是
正确答案
解析
生石灰只能作为干燥剂,不能作为脱氧剂,C选项错误。
考查方向
解题思路
只要理解干燥剂与脱氧剂的区别,即可轻松解决本题。
易错点
混淆脱氧剂与干燥剂的概念。
知识点
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
30.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种
工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为
___ _______________ ______
②“联合制碱法”中相关的化学反应方程式为
③C02是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何
不同 。
31.铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为 ___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
32.钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角
度考虑,上述尾气经处理可用作____ 。
正确答案
①2NH4Cl+Ca(OH)2
②NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl(2分)
2NaHCO3
③ “氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气(1分)
解析
①氨碱法中为回收氨而使石灰乳与副产物氯化铵反应,从而产生大量CaCl 2 废渣。2NH 4 Cl + Ca(OH) 2 =CaCl 2 +2H 2 O+2NH 3 ↑;②联合制碱法的主要化学反应为:
NaCl(饱和)+CO 2 +NH 3 +H 2 O=NaHCO 3 ↓+NH 4 Cl
2NaHCO 3 
③氨碱法的CO 2 来源于石灰石的煅烧,“联合制碱法”的CO 2 来源于合成氨工业的废气;
考查方向
解题思路
氧化还原反应的应用。
易错点
灵活将高中常见化合物性质和实验知识运用于工业生产中。
正确答案
4HR+U4+===UR4+4H
UR4+4H+===4HR+U4+
解析
根据题意可知树脂HR只吸附U4+,所以与氢离子发生交换,反应原理为4HR+U4+=UR4+4H+;
发生离子交换后的离子交换膜用酸处理,再次发生离子交换,得到含铀的溶液,反应原理为UR4+4H+=4HR+U4+ 。
考查方向
解题思路
氧化还原反应的应用。
易错点
灵活将高中常见化合物性质和实验知识运用于工业生产中。
正确答案
①后 ②脱氧和调整钢的成分
③CO ;燃料(或还原剂)
解析
①因为Cr易被氧化,为Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去,
故答案为:后;
②炼钢时,加入硅、锰和铝,可与氧气反应,且能改变合金的性质,起到脱氧和调整钢的成分的作用,
故答案为:脱氧和调整钢的成分;
③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂同时还是一种燃料,
故答案为:CO; 燃料(或还原剂)。
考查方向
解题思路
氧化还原反应的应用。
易错点
灵活将高中常见化合物性质和实验知识运用于工业生产中。
扫码查看完整答案与解析