- 化学平衡状态的判断
- 共46题
己知: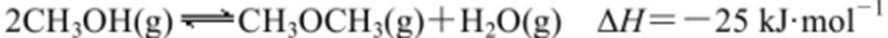
正确答案
解析
略。
知识点
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:
2A (g) +B (s) 
正确答案
解析
略
知识点
工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:2 CrO42- (黄色)+2H+
(1)若第①步中平衡体系的pH=2,则该溶液显_________色;向该溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡_________移动(填“向左”或“向右”或“不变”),溶液颜色将_________。
(2)能说明第①步反应达平衡状态的是_________(选填编号)
A.Cr2O72-和CrO42-的浓度相同
B.2υ(Cr2O72-)=υ(CrO42-)
C.溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应_________(选填编号)
A.平衡常数K值可以不改变 B.再达平衡前正反应速率一定大于逆反应速率
C.Cr2O72-的浓度一定增大 D.平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要_________mol的FeSO4•7H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 
方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为___________________________。
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)_________,溶液中同时生成的沉淀还有_______。
正确答案
(1)橙;向左;变浅
(2)C
(3)AB
(4) 6
(5) 5
(6)阳极反应为Fe-2e→Fe2+,提供还原剂Fe2+
(7)2H++2e→H2↑ Fe(OH)3
解析
略
知识点
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下:
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行:
由乙苯制取苯乙烯反应的
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a、正、逆反应速率的比值恒定 b、c(CO2)=c(CO)
c、混合气体的密度不变 d、CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填
正确答案编号)
a、大于0.5mol/L b、小于0.5mol/L
c、等于0.5mol/L d、不确定
(3)在温度为T2时的恒容器中,乙苯、CO2的起始浓度分别为2.0mol/L和3.0mol/L,设反应平衡后总压强为P、起始压强为

(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
正确答案
(1)+158.8KJ/mol
(2)
(3)
(4)
解析
略
知识点
I.已知:C(s)+H2O(g)
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如右图所示(忽略滴加过程H2S气体的逸出)。试分析:
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
正确答案
I.(1)AD (2)P/P0 ; 79.82%(或0.80)
II.(1)①xCOS(g) = xCO(g)+ Sx(s) ; ΔH=0.5(bx-ax)kJ/mol
(2)①HS-; c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
②M:2S2-+3H+=HS-+H2S
解析
略
知识点
扫码查看完整答案与解析










