- 化学平衡状态的判断
- 共46题
甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)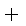
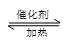
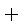
下表所列数据是反应在不同温度下的化学平衡常数(K)。
(1)判断反应达到平衡状态的依据是
A,混合气体的密度不变
B,混合气体的平均相对分子质量不变
C,生成CH3OH的速率与消耗CO的速率相等
D。CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“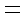
A,加入催化剂 B,充入CO C,充入H2 D,升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c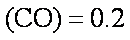
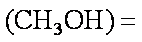
(3)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)

C(s)

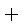
CO(g)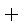

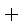
则K1、K2 、K3之间的关系是: 。
正确答案
(1) BD
(2)>、C
(3)0.08 80%
(4) K2=K1·K3
解析
略
知识点
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:
2A(g)+B(g)
正确答案
解析
略
知识点
某恒温密闭容器中,可逆反应A(s)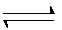
正确答案
解析
略
知识点
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,在地壳浅处容易有________沉积。
(2)如果上述反应的平衡常数K值变大,该反应________(选填编号)。
a. 一定向正反应方向移动
b. 在平衡移动时正反应速率先增大后减小
c. 一定向逆反应方向移动
d. 在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________(选填编号)。
a. 2v正(HF)=v逆(H2O)
b. v(H2O)=2v(SiF4)
c. SiO2的质量保持不变
d. 反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为________。
正确答案
(1)SiF4 、H2O;SiO2
(2)ad
(3)bc
(4)0.0010mol(L·min)
解析
本题考察外界条件对化学平衡的影响、化学平衡常数和化学平衡状态的的理解以及反应速率的有关计算。
(1)地壳深处温度低,使得平衡右移,会逸出SiF4、水蒸气气体;浅处温度高平衡左移动,析出SiO2沉淀。
(2)由于反应吸热,平衡常数K值变大,说明温度降低,则平衡正向移动,温度降低后逆反应速率开始要减小,由于平衡右移动,故逆反应速率又会逐渐增大直至到达新的平衡。
(3)平衡时a项v正(HF)= 2v逆(H2O),d项反应继续进行只是转化的生成物与分解的生成物相等。
(4)密度增大了0.12 g/L,说明质量增加了0.24g,即参加反应的SiO2为0.24g,其物质的量为0.004mol,则转化的HF为0.016mol,则HF的反应速率为
知识点
工业上采用乙苯与
其中乙苯在
(1)上述乙苯与

(2)①乙苯与
②下列叙述不能说明乙苯与
a。
c,消耗


(3)在3L密闭容器内,乙苯与




别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。
①实验I乙苯在0-50min时的反应速率为_______________
②实验Ⅱ可能改变条件的是__________________________
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为
正确答案
(1)
(2)
(每空2分 共4分)
(3)①
②加入催化剂
③
(4)减小(2分);0.225 (2分)
解析
略
知识点
扫码查看完整答案与解析




