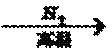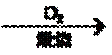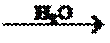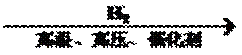- 化学反应的基本原理
- 共38题
16. 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
①质子的流动方向为___________(“从A到B”或“从B到A”)。
②负极的电极反应式为______________________ 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是______________________。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是___________。
正确答案
(1)SO2 + H2O 

(2)H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①从A到B ② SO2 – 2e- + 2H2O == SO42- + 4H+
(4)① H2O + 2SO2 + CO32- == 2HSO3- + CO2↑ ② NaOH [多写Ca(OH)2不扣分]
解析
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3;SO2 + H2O 

由两步反应的能量变化示意可以看出,H2S先被氧化为S(g)释放能量,H2S(g)+0.5O2(g)===S(g)+H2O(g) ΔH = -221.19 kJ·mol-1,然后再S被进一步氧化为 SO42-(aq)释放能量:S(g)+1.5O2(g)+H2O(g)===SO42-(aq) + 2H+(aq) ΔH = -585.20 kJ·mol-1,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;将两个热方程式相加:H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;所以质子的流动方向为从A到B;②由于SO2作负极失去电子,在溶液中一定会生成SO42-,即电极反应式为: SO2 – 2e- + 2H2O == SO42- + 4H+
(4)①由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2, 反应的离子方程式为:H2O + 2SO2 + CO32- == 2HSO3- + CO2↑;②若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH 。
考查方向
通过大气中含硫化合物的转化过程,考查弱电解质的电离平衡、热方程式的书写、电极反应、离子方程式的书写、尾气的处理等中学化学主干知识。
解题思路
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3,然后再发生电离;
由两步反应的能量变化示意可以看出,H2S(g)先被氧化为S(g)释放能量,
(2)然后再被进一步氧化为 SO42-(aq)释放能量,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;
(3)由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;由于SO2作负极失去电子,在溶液中一定会生成SO42-
(4)由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2,若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH。
易错点
多元弱酸的分步电离;书写热方程式要注意物质状态以及焓变值要与系数对应;电极反应、离子方程式的书写都要遵循守恒规律。
知识点
16.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 ▲ 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 ▲ (填序号)。A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

②滤液中Ca(ClO3)2与CaCl2的物质的量之比
n[Ca(ClO3)2] ∶n[CaCl2] ▲ 1∶5
(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为
KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中
尽可能多地析出KClO3固体的方法是 ▲ 。
正确答案
(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;②AB (2)①CaCO3、Ca(OH)2 ②<;
(3)蒸发浓缩、冷却结晶
知识点
14.单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z.X中共价键的类型分别是 。
正确答案
(1)氢氟酸;SiO2+MgO2↑+Mg2Si;
(2)Mg2Si+4HCl=2 MgCl2+SiH4;
(3)非极性键、极性键
知识点
7.下列叙述正确的是
正确答案
知识点
7.下列叙述正确的是
正确答案
解析
A.能与MnO2反应的是浓盐酸且还有加热,故稀盐酸不能除去烧瓶内残留的MnO2;B.因为NaOH溶液能与玻璃成分之一的SiO2反应生成具有粘性的硅酸钠,故不能用磨口玻璃瓶保存NaOH溶液;C.银能被稀硝酸氧化,故稀硝酸可除去试管内壁的银镜,为选项之一;D.自来水煮沸时,其中的Ca(HCO3)2受热分解为CaCO3沉淀,故煮沸自来水可除去其中的可溶性的Ca(HCO3)2,为选项之一。
考查方向
解题思路
依据物质的性质去筛选。
易错点
易漏选。
知识点
1.下列说法不正确的是
正确答案
知识点
9.在给定的条件下,下列选项所示的物质间转化均能实现的是
正确答案
解析
试题分析:A、SiO2与盐酸不反应,错误;B、SO2和H2O反应生成H2SO3,错误;C、N2+3H2
考查方向
解题思路
要熟悉常见物质之间的转化。
易错点
不清楚二氧化硅化学性质的特殊性:与盐酸不反应。
知识点
2.下列化工生产过程中,未涉及氧化还原反应的是
正确答案
解析
A.海带提碘是由KI变为I2,有元素化合价的变化,属于氧化还原反应,错误;B.氯碱工业是由NaCl的水溶液在通电时反应产生NaOH、Cl2、H2,有元素化合价的变化,属于氧化还原反应,错误;C.氨碱法制取碱的过程中没有元素化合价的变化,是非氧化还原反应,正确;D.海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,错误。故选项C正确。
考查方向
解题思路
氨碱法制取碱是把足量的氨气通入饱和的食盐水中,再通入足量的二氧化碳气体,利用碳酸氢钠的溶解度较小的特点使其沉淀析出。发生的反应方程式是:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
易错点
物质的工业制备不清楚原理。
知识点
1.化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( 
正确答案
C
解析
A.酸性高锰酸钾溶液具有强氧化性可氧化乙烯,故A正确。B. SiO2是酸性氧化物,只所以能溶于氢氟酸是硅具有亲氟性的原因,故B错。C.过氧化钠与二氧化碳反应变价元素只有过氧化钠中负一价的氧,并非二氧化碳被氧化,故C错误。D.Al(OH)3受热分解生成H2O并吸收大量的热量,使周围环境温度降低,且生成的氧化铝熔点较高,附着在可燃物表面,从而阻止可燃物燃烧,故D正确。
考查方向
解题思路
A.水果在生长过程中会产生植物激素,来促使植物的果实成熟。常常将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中,就可以用KMnO4的强氧化性将水果产生的乙烯氧化为CO2气体,由于乙烯浓度降低,所以保鲜时间可以更长一些,从而防止了水果的腐烂变质;B.氢氟酸与玻璃的主要成分SiO2发生反应:SiO2+4HF=SiF4↑+2H2O,故可用氢氟酸蚀刻玻璃,但在该反应中Si02不表现酸性;C.过氧化钠与二氧化碳反应变价元素只有过氧化钠中负一价的氧,过氧化钠既是氧化剂,又是还原剂,并非二氧化碳被氧化。D.Al(OH)3受热易分解,产生水并吸收热量,使周围环境温度降低,故可用作阻燃剂。
易错点
A.不了解高锰酸钾会吸收部分乙烯的原理是氧化作用。B.氢氟酸与Si02反应不是由于Si02酸性氧化物的性质;C.不清楚过氧化钠与二氧化碳反应中过氧化钠既是氧化剂,又是还原剂,并非二氧化碳被氧化。D.不仅Al(OH)3受热分解吸热,同时产生水并吸收热量,使周围环境温度降低。
知识点
重铬酸钠(Na2Cr2O7·2H2O)是重要的化工原料,在化学工业和制药工业中常用作氧化剂。可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下流程来制取重铬酸钠。
回答下列问题:
23.写出Cr元素基态原子的外围电子排布式____。
24.步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),反应中被氧化的元素是 ,生成2 mol Fe2O3时转移电子的物质的量为 mol。
25.步骤II中加入NaOH溶液时发生的化学反应方程式为 。
26.+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌。工业上常用电解法来处理含Cr2O72-的废水,电解装置模拟示意图如右图(电极材料为铁和石墨)。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。a电极的电极材料是____,b电极附近生成Cr3+的反应的离子方程式是____。
27.将含Cr2O3为50%的铬铁矿30.4 kg,按上述流程制取产品Na2Cr2O7·2H2O,假设整个流程中铬元素的利用率为80%,则最终能制得Na2Cr2O7·2H2O kg。
正确答案
(1)3d54s1
解析
(1):Cr元素在第4周期,结合洪特规则,可知其有4个电子层,第一层2个电子,第二层排满8个电子,第三层最大容量18个电子,但由于亚层电子数量在半满态时性质比较稳定,故其亚层应该是3s23p63d5,第四层为一个电子,由于能级交错现象,其电子排布为1s22s22p63s23p64s13d5,由于习惯将相同电子层的写在一起,故为1s22s22p63s23p63d54s1,外层电子排布为3d54s1;
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(2)Fe、Cr ;28
解析
(2):由化学方程式:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)可知,其中化合价升高的有Fe元素和Cr元素,反应物和生成物相比,Fe2+→Fe3+,Cr3+→Cr6+,生成2mol的Fe2O3,参照反应式各个物质的系数,则同时生成8mol的Na2CrO4,故转移的电子物质的量为4mol+24mol=28mol;
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(3)2NaOH+Al2O3=2NaAlO2+H2O
解析
(3):由于Al具有两性,故其氧化物与碱反应:Al2O3+NaOH=NaAlO2+H2O;
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(4)石墨 ;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
解析
(4):30.4kg 含50%Cr2O3的铬铁矿,其含Cr2O3为30.4kg×50% = 15.2kg,参与反应时其利用率为80%,则参与反应的Cr2O3为15.2kg×80% = 12.16kg,Cr2O3的相对原子质量为152,根据Cr元素物质的量守恒,1分子Cr2O3生成1分子的Na2Cr2O7·2H2O,而Na2Cr2O7·2H2O相对分子质量为298,所以相对分子质量之比:152 / 298 = 12.16 / M(Na2Cr2O7·2H2O) , 故M(Na2Cr2O7·2H2O)=23.84kg
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(5)23.84
解析
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
扫码查看完整答案与解析