- 性质实验方案的设计
- 共28题
为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:小水制作
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为: _____________(注明你的表达式中所用的有关符号的含义和单位)。
正确答案
(1)电子天平;250 mL的容量瓶
(2)2Na2SO3+ O2→ 2Na2SO4。
(3)使SO32-充分转化为气体,使SO42-完全沉淀,静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。
(4) 偏高
(5)<,方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大。
(6)a,
解析
略
知识点
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)请完成表格中的填空:
II、牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是: 。
(3)C中反应生成BaCO3的化学方程式是 。
(4)下列各项措施中,不能提高测定准确度的是 (填标号)。
A,在加入盐酸之前,应排净装置内的CO2气体
B,滴加盐酸不宜过快
C,在A—B之间增添盛有浓硫酸的洗气装置
D,在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g,则样品中碳酸钙的质量分数为 。
(6)某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
正确答案
(1)①Al(OH)3+OH―→AlO2― +2H2O ;②有白色沉淀产生
③AlO2―+CO2+2H2O→Al(OH)3↓+HCO3― ;④沉淀溶解,有气体产生
(2)驱赶残留在装置中的CO2 以使生成的CO2完全被吸收
(3)CO2+Ba(OH)2 →BaCO3↓+H2O
(4)CD
(5)0.25(25%)
(6)
D装置吸收反应生成的CO2外,还会吸收挥发出的HCl,同时空气中的H2O和CO2 也会进入D装置。使m2-m1偏大
解析
略
知识点
10.一溴乙烷在制药,杀虫剂,汽油抗震液中铅的消除剂中有着广泛的应用。工业上和实验室中都可用如下过程制备一溴乙烷。
某同学在实验室中模拟整个生产过程,查阅资料如下:
生产原理:NaBr+H2SO4=HBr↑+NaHSO4
正确答案
解析
(1)使反应平稳进行,防止乙醇、HBr大量挥发,充分蒸出一溴乙烷。
(2)SO42-,取少量水层1的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液。
(3)
(4)67%
知识点
为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)
实验操作和现象:
(1) A中反应的化学方程式是 ________________ 。
(2) C中可溶性钡盐溶液X为___________ 。实验过程中,发现液体Y不能很顺利地滴下,则可如何改进: ______________- 。
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是 __________ ,乙同学认为是白雾参与反应。
为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间。乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D。
甲、乙各自进行实验,B中现象分别如右表:由此得出的结论是 __________ 。
(4) 丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体。C中反应的化学方程式是______________ 。
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体。C中沉淀为________。实验室里欲获得该沉淀,所需要的玻璃仪器是 ____________- 。
(6) 结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是_______________。
正确答案
(1)
(2)硝酸钡
将分液漏斗改为恒压漏斗(其他合理说法也给分)
(3)空气参与了反应;
空气、白雾均是产生白色沉淀的原因,其中白雾是主要原因。
(4)3SO2+ 2H2O+ 3Ba(NO3)2 + →3BaSO4↓+2NO↑+ 4H NO3
(5)BaSO3、氢氧化铝; 烧杯、漏斗、玻璃棒;
(6)SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀。
解析
略
知识点
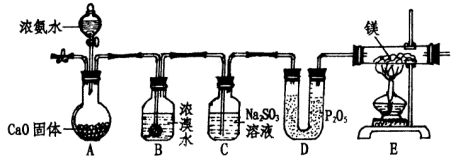
28.已知:①Br2与Cl2一样能氧化氨气。
②镁条能在N2中燃烧生成黄绿色固体,遇水剧烈反应生成两种碱。
`某化学学习小组设计下列装置来制取氨气并完成相关实验。
(1)实验步骤:
①点燃E处酒精灯;
②打开A中分液漏斗活塞;
③连接装置,检查装置气密性;
④通入惰性气体,排出装置内空气;
⑤装入各仪器药品。
其操作顺序是( )。(填序号)
(2)A处固体CaO的作用是( );
(3)写出B处反应方程式 ( );
(4)C处亚硫酸钠的作用是:( )(用文字及相关离子方程式叙述);
(5)能说明反应过程有N2生成的现象是( );
(6)此装置不足之处是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.已知:①


②镁条能在N2中燃烧生成黄绿色固体,该固体遇水剧烈反应生成两种碱。
某化学学习小组设计下列装置来制取氨气并完成相关实验。
(1)实验步骤:
①点燃E处酒精灯;
②打开A中分液漏斗活塞;
③连接装置,检查装置气密性;
④通入惰性气体,排出装置内空气;
⑤将药品装入各仪器装置内。
其正确的操作顺序是( )(填序号)。
(2)A处固体CaO的作用是 ( ) 。
(3)分别写出B处、E处反应的化学方程式( ), ( )。
(4)C处亚硫酸钠溶液的作用是:( )(用文字及相关离子方程式叙述);
(5)能说明反应过程中有N2生成的现象是( ) 。
(6)此装置不足之处是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.将如下仪器(部分夹持及连接装置巳省略)进行合理组装,既可用于物质制备,又可用于物质的性质验证。请回答下列问题,
(1) 利用装置A、B制取氨气并进行性质实验。分液漏斗中试剂为浓氨水,圆底烧瓶中试剂为生石灰,B中烧杯内试剂为AlCl3溶液。打开分液漏斗旋塞,圆底烧瓶中即有氨气生成,该反应的化学方程式是:_____________________—段时间后,观察到烧杯中的现象是______________;B中球形干燥管的作用是______________。
(2)选择上图部分装置制取SiCl4。已知:
①SiCl4沸点为57.7°C、熔点为-70.0°C,遇水极易水解;
②硅与氯气共热到450〜500°C可反应生成SiCl4;
③
制取四氯化硅正确的装置连接顺序为:A→C→C→_______→_______→_______(填装置序号);前后两次C中所装试剂分别为_______、_______;该连接顺序中最后一个装置的作用是______
(3)选择上图部分装置制取SO2并验证其相关性质。将制得的SO2通入酚酞与NaOH的混合溶液中,可观察到溶液红色褪去。甲认为红色褪去的原因是SO2水溶液呈酸性:乙认为红色褪去的原因是SO2水溶液具有漂白性。在不加热的条件下,试设计一个实验方案,判断甲、乙看法是否正确。简要写出实验步骤及观察到的现象_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中。
(2)装置a的作用是 (填序号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.Ⅰ、下面a~e是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托平天平 e、温度计
(1)上述仪器中标有0刻度的玻璃仪器是( )(填序号)。
(2)若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、( ) 。
Ⅱ、某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有( )(写出两种即可)。
(2)A、B、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行如下①、②两个实验,实验操作、现象、结论如下:
请你评价实验①、②的结论是否合理?( );若不合理,请说明理由:( ) 。
(3)将B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),制得NO2后,进行以下实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹( ),再打开止水夹( ),使烧杯中的水进入试管丁的操作是( )。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通人一定量的O2,直至试管全部充满溶液,则原NO2与通人O2的物质的量之比为( )。
③尾气吸收的装置是( )(填序号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列实验方案能达到预期目的的是( )
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼V(钒),铝作还原剂
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析