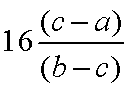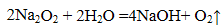- 性质实验方案的设计
- 共28题
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu元素的相对原子质量,同时检验氯气的氧化性。
(1)为完成上述实验,正确的连接顺序为A连_________;B连_________(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为___________________________。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是_________,对应的现象为_____________________。
(4)丙装置的c瓶中盛放的试剂为 _________,作用是___________________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:_________方案测得结果更准确。你认为不合理的方案的不足之处在___________________________。
②按测得结果更准确的方案进行计算,Cu,的相对原子质量是___________________________。
正确答案
(1)E C
(2)检验氢气的纯度,(赶走系统内空气)防止发生爆炸
(3)淀粉KI溶液 溶液变为蓝色
(4)浓硫酸 吸收H2中的H2O
(5)①甲 空气中的CO2和H2O通过D口进入U形管造成实验误差较大
②
解析
略
知识点
某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ. 将光亮铜丝插入浓硫酸,加热;
Ⅱ. 待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ. 冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤Ⅱ产生的气体是______。
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是______。
(3)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红褐色沉淀,证明有Cu2+。
① 将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
② 将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。
由该检验过程所得结论是 。
(4)再次假设,黑色沉淀是铜的硫化物。实验如下:
① 现象2说明黑色沉淀具有______性。
② 产生红棕色气体的化学方程式是______。
③ 能确认黑色沉淀中含有S元素的现象是 ,相应的离子方程式是 。
④ 为确认黑色沉淀是“铜的硫化物”,还需进行的实验是_____。
(5)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是______。
正确答案
见解析。
解析
(1)SO2
(2)将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤
(3)黑色沉淀中不含有CuO
(4)① 还原性
② 2NO +O2==2NO2
③ B试管中出现白色沉淀
NO2 + SO2 + Ba2+ + H2O == BaSO4↓+ NO↑+ 2H+
④ 取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物
(5)
知识点
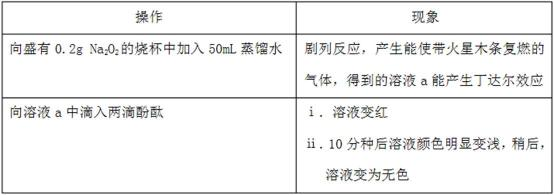
某小组通过实验研究Na2O2与水的反应。
(1)Na2O2与水反应的化学方程式是 。
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂 (填化学式),有气体产生。
Ⅱ.乙同学查阅资料获悉:用KMnO4 (被还原为Mn2+)可以测定H2O2的含量。
取3 mL溶液a稀释至15mL,用稀H2SO4酸化,再逐滴加入0.0045 mol·L-1 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10 mL KMnO4溶液。
①KMnO4与H2O2反应的离子方程式是 。
②溶液a中c(H2O2)= mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是 。
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅰ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol·L-1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色,该过程无明显热效应。
Ⅱ.向0.1mol·L-1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化。
② 从实验Ⅰ和Ⅱ中,可得出的结论是 。
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中, 。
正确答案
见解析。
解析
(1)
(2)Ⅰ.
Ⅱ.①
②0.0375
③反应生成的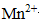
(3)①碱性条件下,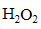
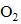
②加入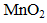
知识点
铜与硝酸反应的实验设计铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境。改进实验的设计符合绿色化学的思想。某兴趣小组设计出右图所示装置来改进教材中“铜与硝酸的反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 ,理由是 。
(4)该小组还用上述装置进行实验,
证明氧化性KMnO4>Cl2>Br2。
① 操作步骤为 ;
② 实验现象为 ;
③ 此实验的不足之处是 。
正确答案
(1)检查装置气密性(2分)
(2)Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O(2分) 反应变缓,气体颜色变淡(2分)
(3)丙(2分) 耗酸量最少,无污染 (2分)
(4)①向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸 (2分)
②c中有黄绿色气体产生,d中溶液变为黄棕色(2分) ③没有处理尾气(2分)
解析
略
知识点
为测定碳酸氢钠纯度(含少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析