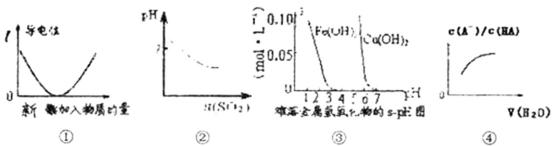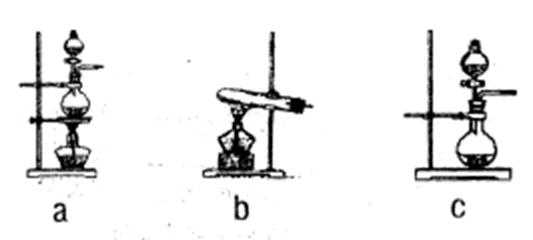- 化学能与热能的相互转化
- 共33题
10.下列说法中,正确的是
正确答案
解析
A.2gH2为1mol,完全燃烧生成液态水,放出285.8kJ热量,则2molH2燃烧放出的热量应为517.6KJ,氢气燃烧的热化学方程式应为2H2(g)+O2(g)=2H2O(1);△H=-517.6kJ/mol,所以A正确;B.中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,同时热方程式必须注明物质的聚集状态,所以表示中和热的化学方程式:H+(aq)+OH-(aq)=H2O(1) △H= -57.3kJ•mol-1,所以B错误;C.将水库中的水闸(钢板)与外加直接电源的负极相连,做阴极被保护,正极连接到一块废铁上可防止水闸被腐蚀,所以C错误;D.当气体转化为固体时要放出热量,故等量的S(g)和S(s)分别完全燃烧,S(g)放出的热量多,由于放热△H是负值,则放热越多,△H越小,即a>b,所以D错误。
考查方向
解题思路
热化学方程式中各物质化学式前的化学计量数仅表示该物质的物质的物质的量,并不表示物质的分子或原子数。因此化学计量数以“mol”为单位,数值可以是小数或分数。同时反应物和产物的聚集状态不同,反应热△H也不同。因此,必须注明物质的聚集状态,由于已经注明物质的聚集状态,所以热化学方程式中不用↓和↑。在所写的化学方程式的右边写下△H的“+”与“-”数值和单位,若为放热反应,△H为“-”,若为吸热反应,△H为“+”,由于△H与反应完成的物质的量有关,所以化学计量数必须与△H相对应。A.2gH2为1mol,完全燃烧生成液态水,放出285.8kJ热量,则2molH2燃烧放出的热量应为517.6KJ;B.中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,同时热方程式必须注明物质的聚集状态;C.在电解池中,阳极金属更容易被腐蚀,阴极上的金属被保护,将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀。D.S(g)和S(s)的聚集状态不同,当气体转化为固体时要放出热量,故等量的S(g)和S(s)分别完全燃烧,S(g)放出的热量多。
易错点
热方程式中容易漏写物质的聚集状态致错;在放热反应中,由于放热
△H是负值,则放热越多,△H越小。
知识点
1. 下列说法正确的是( )
正确答案
解析
A.油脂在人体内水解为高级脂肪酸和甘油,蛋白质在人体中水解生成氨基酸,故A错误;
B.“拍”到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的分子间作用力,不属于化学键,故B错误;
C.钠与熔融的盐反应发生置换反应,生成相应的单质,所以高温时可用金属钠还原相应的氯化物来制取金属钛,故C正确;
D.活性炭脱色是利用其吸附性,次氯酸盐漂白是利用次氯酸的强氧化性,故D错误
考查方向
解题思路
A.油脂在人体内水解为高级脂肪酸和甘油;
B.氢键属于分子间作用力,不属于化学键;
C.钠与熔融的盐反应发生置换反应,生成相应的单质
D.依据活性炭与次氯酸的漂白原理解答。
易错点
B项容易混淆氢键和化学键的关系,为易错点。
知识点
13.下列图示与对应的叙述相符的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
31.含氮化合物是常见的化学物质,它们对人类的生产生活,有着重要的影响:
(1)氨气是合成其他含氮化合物的重要原料,也是实验室常用试剂。Ph=9的氨水中由水电离的[OH-]__________mol·L-l,向浓度均为0.1 mol·L-l的FeCl3、AlCl3溶液中缓慢通入足量的氨气,先生成的沉淀是_______________________(填化学式),理由是_______________________。
注:Ksp[Fe(OH)3]=2.8×l0-39 ,Ksp[Al(OH)3]=1.3 ×l0-33
(2)氮氧化合物属于常见大气污染物,汽车尾气的排放是空气中氮氧化合物的主要来源,用尿素(
①用浓硝酸和铜片反应制取二氧化氮气体,发生装置应选择_____(填所选装置编号);
②将①所选装置与下面装置组装完毕后,应先_________________,然后添加药品开始反应,将①所选装置中产生的二氧化氮气体通入下列装置进行相关实验。A装置可冷凝除去二氧化氮中的硝酸蒸气,其另一作用为_______________________;
③若实验过程中依次观察到下列现象:红棕色气体经过B装置变为无色;C装置固体变为蓝色;D装置澄清石灰水变浑浊;E装置中收集到无色无味气体,遇空气不变色。试推测该反应的产物为_________,氧化剂、还原剂的物质的量之比为_________;
④C、D装置可否颠倒顺序_______(填“可”或“否”),理由是____________________。
正确答案
(1)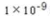
(2)
①C
②检查装置的气密性;干燥气体
③水蒸气、二氧化碳和氨气; 3:2
④否;无法证实水蒸气的存在
解析
解析已在路上飞奔,马上就到!
知识点
11.下列离子组在一定条件下能大量共存,且加入试剂后发生反应的离子方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列图示与对应的叙述相符的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.常温下,某酸HA的电离常数:K=1×10-5,下列说法正确的是( )
正确答案
解析
A选项中HA溶液中加入HA溶液中加入NaA固体后抑制了HA的电离,
考查方向
解题思路
A选项中HA溶液中加入HA溶液中加入NaA固体后抑制了HA的电离,
易错点
1、同离子的抑制作用 。
2、物料守恒的应用。
知识点
12.A、B、C、D均属于短周期元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和。下列说法中正确的是
正确答案
解析
A、B、C、D均属于短周期元素。A是元素周期表所有元素中原子半径最小的,则A为H元素;B只有两个电子层,其中一层电子数是另一层的两倍,则B为C元素;C只有两个电子层,其中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素;据此解答各小题即可。A.元素的非金属性越强,简单离子的还原性越弱,O2-的简单离子的还原性小于S2-,A错误;
B.在自然界中硫的存在形式有游离态和化合态,单质硫主要存在于火山周围的地域中,以化合态存在的硫多为矿物,可分为硫化物矿和硫酸盐矿,B错误;
C.A元素所形成离子H-,核外电子排布和He原子相同,但核电荷数小,因此H-的半径有可能大于He原子的半径,C正确;
D.C、S的原子能相互结合形成化合物CS2,D错误。
故选C。
考查方向
解题思路
A、B、C、D均属于短周期元素。A是元素周期表所有元素中原子半径最小的,则A为H元素;B只有两个电子层,其中一层电子数是另一层的两倍,则B为C元素;C只有两个电子层,其中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素;据此解答各小题即可。A-H、B-C、C-O、D-S。
易错点
本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律。
知识点
扫码查看完整答案与解析