- 有关混合物反应的计算
- 共90题
CuO和Fe2O3的混合物m g,向其中加入1 mol·
正确答案
解析
略
知识点
Fe、Cu、Al是常见的金属元素,按要求回答下列问题:
(1)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________(填编号)。
A. 溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
B. 溶液中有Fe2+、Al3+,不溶物为Cu、Fe
C. 溶液中有Fe3+、Al3+,不溶物为Cu
D. 溶液中有Fe2+,不溶物为Cu、Al
(2)将一定质量的铁、铝、铜合金,加入1L 一定物质的量浓度的硝酸中完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L,c(Cu2+)=0.3mol/L,c(Al3+)=0.2mol/L,c(NO3-)=2mol/L,则混合物中铁的质量为________。
(3)在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析证明白色沉淀是碘化亚铜,该反应的离子方程式为________。
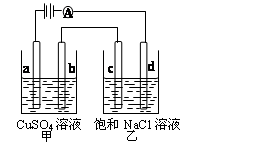
(4)Li-Al/FeS是一种可充电电池,电池中用含Li+导电固体作为电解质,在工作过程中Li+的物质的量保持不变,其正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,则电池的负极反应式为________。充电时,阳极发生反应的物质是________。用该电池作电源,组成如右图所示装置(a、b、c、d均为石墨电极)。电解后向甲中加入适量的________(填物质化学式),可以使溶液恢复到原来状态,当500mL乙溶液的pH为13时,在b极上生成物质的质量为________。
正确答案
(1)ab
(2)5.6g
(3)2Cu2++4I-=2CuI↓+I2
(4)2Li-2e-=2Li+; Li2S、Fe;CuO;1.6g
解析
略。
知识点
已知:2[NaAl(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
正确答案
解析
略
知识点
合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入

正确答案
解析
略
知识点
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。
能确定混合物中Y的质量分数的数据有 (填序号)。
a. m、n
b. m、y
c. n、y
正确答案
见解析。
解析
(1)ⅣA (2)Na
(3)① b c ②电子层数相同,质子数Y > X
(4)HN3+NaOH=NaN3+H2O c(Na+)>c(N3-)>c(OH-)>c(H+)
(5)a b c
知识点
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,测得溶液中含盐酸盐溶质共W2 g。下列所列关系式中正确的是 ( )
正确答案
解析
略
知识点
已知H2S 有可燃烧性,燃烧时氧气的量不同,产物也不同。
(1)在标准状况下,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为15mL,该15mL气体可能是( )
A,H2S和SO2 B,O2 C,H2S D,SO2和O2
(2)、若标准状况下,上述气体,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为30mL,求原气体可能的组成。
(3)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时点燃会发生爆炸,当硫化氢在空气中的体积分数为20%时,其爆炸产物是 。
(4)在标准状况下,将120mL H2S和O2的混合气体点燃,若原混合气体中H2S 为x mL,反应后所得气体的总体积为y mL,求:
①当x在不同范围时y与x的函数关系。
②当y=60mL时,原H2S 的体积可能是多少。
正确答案
(1)C
(2)①H2S:90mL O2:30mL ② H2S:60 mL O2:60mL
(3)S、SO2、H2O
(4)①120>x≥80 y=3x-240 0<x≤80 y=120-1.5x
②100mL 40mL
解析
略
知识点
用NaHCO3和KHCO3组成的混合物分别与三份同浓度的盐酸进行反应,测得数据如下:
则下列结论中不正确的是
正确答案
解析
略
知识点
已知2.1克KOH和1.6克S混合后加热,恰好反应:aKOH+bS→cK2Sx+dK2S2O3+eH2O,则x的值为
正确答案
解析
略
知识点
某溶液中含有大量的Cl一、Br一、I一,若向l L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为
正确答案
解析
略
知识点
扫码查看完整答案与解析