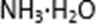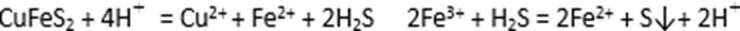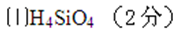- 离子浓度大小的比较
- 共173题
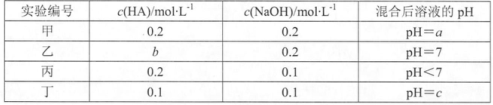
11.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
下列对混合后溶液的有关说法中,不正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.25℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
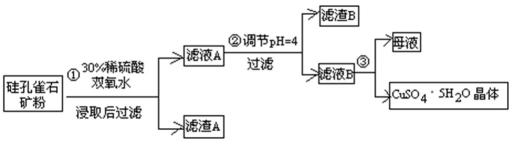
28.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为
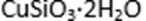
请回答下列问题:
(1)完成步骤①中稀硫酸与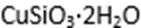
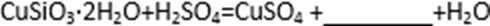
(2)步骤②调节溶液pH选用的最佳试剂是( )
A. CuO B. MgO C. FeCO3 D.
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是( )。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到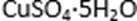
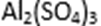
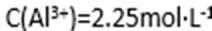
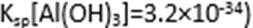
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
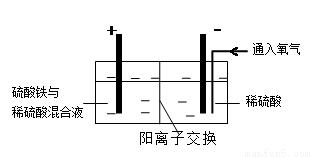
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+ Cu2+(水相)
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是( )(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是( ) 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.向NaOH(aq)滴入HCOOH(aq)的过程中,所得到的混合溶液中离子浓度的大小关系可能正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.Ⅰ.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I2+Z+H2O常作为Y的鉴定反应。W是短周期元素,最外层电子数是最内层电子数的三倍,吸引电子对的能力比X单质的组成元素要弱。
(1) Z的化学式__________________
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别Y和二氧化硫的实验方法:________________________________________________________。
(3)举出实例说明X的氧化性比W单质氧化性强(仅用一个化学方程式表示):_____________。
Ⅱ.如图是0.1 mol·L-1四种电解质溶液的pH随温度变化的图像。
(1)其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),
(2)20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+))-3c(Al3+)=________。(计算精确值)
(3)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为( )。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。
回答:0~10 min内,氢气的平均反应速率为( )mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡( )(填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电电解300mL 某NaCl溶液,正极反应式为( )。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为( )mol。
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3( ) 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 ( )(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)( )c(NH3·H2O)。(填“>”、“<”或“=”)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将

①若HA为HCN,该溶液显碱性,则溶液中c(CN—)( )c(Na+)(填“<”、“=”或“>”),你得出该结论的依据是( )。
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是( )
(2)二氧化氯(ClO2)为一种黄绿色气体,
①图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:( )。
②电解一段时间,当阴极产生的气体体积为336 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为( )mol;用平衡移动原理解释阴极区pH增大的原因( )。
(3)25℃时,



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3•H2O溶液,滴定曲线如下图。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.有酸HA与碱BOH,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析