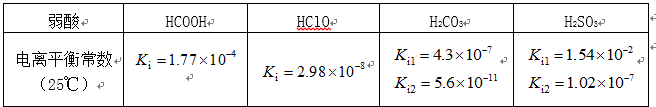- 离子浓度大小的比较
- 共173题
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
正确答案
解析
浓度均为0.1000 mol/L的三种酸HX、HY、HZ,根据滴定曲线0点三种酸的pH可得到HZ是强酸,HY和HX是弱酸,但酸性:HY>HX。因此,同温同浓度时,三种酸的导电性:HZ>HY>HX。B选项:当NaOH溶液滴加到10 mL时,溶液中c(HY)≈c(Y—),即Ka(HY)≈c(H+)=10—pH=10—5。C选项:用NaOH溶液滴定至HX恰好完全反应时,HY早被完全中和,所得溶液是NaY和NaX混合溶液,但因酸性:HY>HX,即X—的水解程度大于Y—,溶液中c(Y—)>c(X—)。D选项:HY与HZ混合,溶液的电荷守恒式为:c(H+)=c(Y—)+ c(Z—) +c(OH—),又根据HY的电离平衡常数:
Ka(HY)=
即有:c(Y—)=
所以达平衡后:c(H+)=
知识点
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) 
(1) 已知:850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
下列说法正确的是_______(填序号)
A. 达到平衡时,氢气的物质的量是0.12mol
B. 达到平衡时,反应体系最终会放出49.44kJ热量
C. 第4min始,混合气体的平均相对分子质量不再变化
D. 第6min时,若升高温度,反应平衡常数会减小
E. 第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______。
(3)研究小组采用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5 mol·L-1的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是_______。
(4) 如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g) 
H2(g) + 1/2O2(g) 
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 _______。
(5) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是_______。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_______。实验过程中,若通入了标准状况下空气448 L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4_______L。
正确答案
(1)BD
(2)3>x≥0或 x<3
(3)c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
(4)CO2(g) + 4H2(g) 
(5)O2+2CO2+4e-=2CO32-(或2O2+4CO2+8e-=4CO32-);CO2;44.8
解析
(1)由图像看出,反应在4min达到平衡,平衡时消耗H2O、CO的物质的量浓度均为0.12 mol·L-1,故生成的H2和CO2的物质的量浓度也为0.12 mol·L-1,其物质的量为1.2mol,A项错误;有1.2molH2O参加反应,根据热化学方程式可计算放出的热量为1.2mol×41.2 kJ·mol-1=49.44kJ,B项正确;由于该反应体系中全部是气体,且气体物质的量不变,故混合气体的平均相对分子质量是恒量,不会随反应的进行而变化,C项错误;该反应为放热反应,升温平衡左移,化学平衡常数减小,D项正确;氦气为惰性气体,不会影响该反应的平衡状态,E项错误。
(2)若要使上述反应开始时向正反应方向进行,其浓度商应小于该温度下的平衡常数,即Q=<K= 解得x<3。
(3)通入CO2反应后所得溶液为等物质的量浓度的Na2CO3和NaHCO3的混合溶液,故其离子浓度大小顺序为c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)。
(4)将已知的两个热化学方程式按顺序编号为①②,根据盖斯定律②×4-①可得热化学方程式:CO2(g) + 4H2(g) 
(5)写出电池总反应方程式CH4+2O2=CO2+2H2O,减去负极的电极方程式可得正极电极方程式:2O2+4CO2+8e-=4CO32-;由正、负极电极式看出,参与循环的物质为CO2;由电池总方程式可得:消耗CH4的体积为448L××=44.8L。
知识点
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
有关物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率
平衡常数表达式为
(2),相同温度下,若开始加入
A,平衡常数
B,
C,达到平衡的时间
D,平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的 ( )
A,充入少量氨气
B,降温至0℃
C,充入少量硫化氢
D,加压
(4)常温下,将
① 浓度为
② 
③ 
则a、b、c、d之间由大到小的关系是: 。
(5)常温下,取
表示醋酸溶液中pH变化曲线的是 (填“A”或“B”);设盐酸中加入的Zn质量为



(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
A,在A、B间任一点,溶液中一定都有
B,在B点,
C,在C点:
D,在D点:
正确答案
(1)0.1mol/(L·min)
(2)BD
(3)A
(4)b>a=d>c
(5)B,<
(6)D
解析
略
知识点
下列溶液中微粒浓度关系一定正确的是
正确答案
解析
略
知识点
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)
2NO(g)+Cl2(g)
(1)4NO2(g)+2NaCl(s)
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=_______mol,NO的转化
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3-).c(NO2-)和c(CH3COO-)由大到小的顺序为_______。(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数K a=1.7×10-5mol•L-1,可使溶液A和溶液B的pH相等的方法是_______。
a. 向溶液A中加适量水
b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水
d. 向溶液B中加适量NaOH
正确答案
(1)
(2)2.5x10-2; 75%;>;不变;升高温度
(3)c(NO3-)>c(NO2-)>c(CH3COO-);b.c
解析
略。
知识点
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为_______。要清洗附着在试管壁上的硫,可用的试剂是_______。
(2)下图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+
(3) Na2S溶液中离子浓度由大到小的顺序为_______,向该溶液中加入少量固体CuSO4,溶液pH_______(填“增大”“减小”或“不变”), Na2S溶液长期放置有硫析出,原因为_______(用离子方程式表示)。
正确答案
(1)2CH3CH2OH + 2Na
(2)xS+2e- = Sx2- ;离子导电(导电或电解质)和隔离钠与硫;4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;2S2-+ 2H2O+O2=2S+ 4OH-
解析
(1)乙醇与钠反应的方程式为:2CH3CH2OH + 2Na
(2)正极上是S得到电子发生还原反应:xS+2e- = Sx2-;要形成闭合回路,M必须是能使离子在其中定向移动的,故M的两个作用是导电和隔膜;假设消耗的质量都是207 g,则铅蓄电池能提供的电子为2 mol,而钠硫电池提供的电子为
(3) Na2S溶液中,存在的水解反应为:H2O + S2- 

知识点
常温下,用 0.1000 



正确答案
解析
略
知识点
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
正确答案
解析
本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。A:在0.1 mol·L-1NaHCO3溶液中,HCO3-在溶液中存在水解与电离两个过程,而溶液呈碱性,说明水解过程大于电离过程,c(H2CO3)>c(CO32-)B:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)中把c(H+)移项到等式另一边,即是一条质子守恒关系式。C:向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液后,相当于0.05 mol·L-1的Na2CO3溶液,Na2CO3在水中水解,OH-包括两步水解和水的电离产物,因此,c(OH-) >c(HCO3-)。D:常温下,CH3COONa和CH3COOH混合溶液,包括CH3COO-水解和CH3COOH电离两个过程,既然pH=7, 根据电荷守恒式,不难得出c(Na+)=c(CH3COO-) =0.1 mol·L-1,c(H+)=c(OH-)=1×10-7 mol·L-1。水解是有限的,c(CH3COOH)约为c(CH3COO-)的百分之一左右。
知识点
部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A,2ClO- + H2O + CO2 → 2HClO + CO32-
B,2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C,H2SO3 + 2HCOO- → 2HCOOH + SO32-
D,Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是
A,H2O2既是氧化剂又是还原剂
B,H2O 既不是氧化产物又不是还原产物
C,H2SeO4既是氧化产物又是还原产物
D,氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,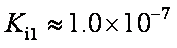
HI+ H6TeO6
(6)若反应中生成的TeO2与Te的物质的量之比为
正确答案
(1)Ki值越大,酸性越强
(2)BD
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4
(5)C
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O
解析
略
知识点
25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度关系叙述正确的是
正确答案
解析
本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。
ApH=5.5比4.75大,从曲线来看CH3COOH的电离在增大,CH3COO-的水解在减小,不可能出c(CH3COOH)>c(CH3COO-)。BC中W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)是完全正确的,其实这关系在溶液中始终存在。pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)再把题干中的c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1代入即可。D选项向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡。
溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);
物料守恒关系为:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 ,不可能得出上述结论。
知识点
扫码查看完整答案与解析