- 离子浓度大小的比较
- 共173题
常温时向

正确答案
解析
略
知识点
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为__________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是__________。
(2)滤渣A的成分除MnO2外,还有__________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为__________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为__________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为__________g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是__________>__________>__________(填写化学式)。
正确答案
(1)MnO+2H+=Mn2++H2O;确保铁元素在后续操作中完全转化为氢氧化物沉淀而除去
(2)Al(OH)3、Fe(OH)3
(3)Zn+2OH--2e-=Zn(OH)2;Mn2++2H2O-2e-=MnO2+4H+;17.4
(4)Mn(OH)2>MnCO3>MnS
解析
略。
知识点
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
正确答案
解析
略
知识点
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)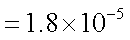
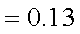
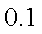
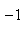
正确答案
解析
略
知识点
对于物质的量浓度均为0.01mol·L-1①NaHCO3 ②Na2CO3 ③CH3COOH ④CH3COONa四种溶液下列说法正确的是
正确答案
解析
略
知识点
25℃时,已知弱酸的电离常数:K(CH3COOH) = 1.8 ×10-5;K1(H2CO3) = 4.4 ×10-7;K2(H2CO3) = 4.7 × 10-11;K(HClO) = 4.0 ×10-8。则下列说法正确的是
正确答案
解析
略。
知识点
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是
正确答案
解析
略
知识点
常温下,对于 ① 0.1 mol/L CH3COOH溶液 ② pH = 1 HCl溶液 ③ pH =13的NaOH溶液 ④ 0.1 mol/L CH3COONa溶液,下列说法正确的是
正确答案
解析
略
知识点
某混合物水溶液,可能含有以下离子中的若干种: K+、NH4+、Cl- 、Ca2+、CO32-、 SO42-,现每次取100 mL溶液分别进行下列实验:
下列说法正确的是
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析

















