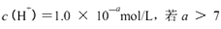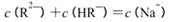- 离子浓度大小的比较
- 共173题
下列说法正确的是
正确答案
解析
略
知识点
常温下,取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
略
知识点
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为_________mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3_________0(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
① 由上表判断,NaHSO3溶液显_________性,用化学平衡原理解释:_________。
② 当溶液呈中性时,离子浓度关系正确的是(选填字母):_________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
正确答案
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1
(2)①0.225;正向;②O2 + 4e-+ 4H+=2H2O;0.005;③<
(3)①酸;溶液中存在:HSO3-

解析
略。
知识点
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0。1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如右图所示,下列叙述正确的是
正确答案
解析
略
知识点
(1)1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为_________;生成0.1molK2FeO4转移的电子的物质的量_________mol
2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O
放电时电池的负极反应式为_________。充电时电解液的pH_________(填“增大”“不变”或“减小”)。
(2)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH)_________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_________(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=_________mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_________;在b点,溶液中各离子浓度由大到小的排列顺序是_________。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的Al3+_________(填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
正确答案
(1)1)2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O;0.3 ;2)Zn + 2OH- - 2e- = Zn(OH)2;减小
(2)1) 小于 ;2)①A;②10-3-10-11 ;3)a;c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+) ;4)能
解析
略。
知识点
有①氨水
②NH4Cl溶液
③Na2CO3溶液
④NaHCO3溶液各25 mL,
物质的量浓度均为0.1 mol/L,下列说法正确的是
正确答案
解析
略
知识点
下列各溶液的叙述中不正确的是
正确答案
解析
略
知识点
25℃时,向20。00mLNaOH溶液中逐滴加入0。20mol·L-1的CH3COOH溶液得到如图曲线。下列说法正确的是
正确答案
解析
略。
知识点
常温下,浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液 ②NaOH溶液 ③CH3COONa溶液。下列说法中不正确的是(忽略混合前后溶液体积变化)
正确答案
解析
略
知识点
扫码查看完整答案与解析