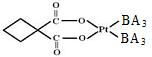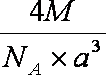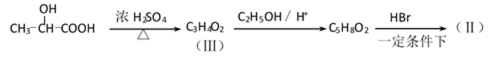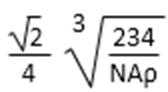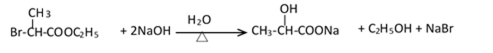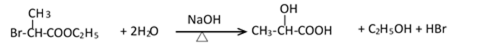- 物质结构与性质
- 共518题
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
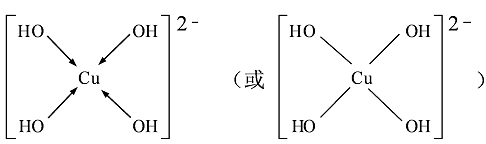
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
正确答案
见解析。
解析
(1)①1s22s22p63s23p63d5(或[Ar]3d5)
②平面三角形
(2)①C≡O ②sp3 ③2×6.02×1023个(或2mol)
(3)
本题科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、[Cu(OH)4]2-结构等《选修三》基础知识的掌握和应用能力。本题基础性较强,重点特出。
知识点
A、B、C、D、E、F均为周期表中前四周期的元素。请按要求回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关A、B的叙述不正确的是______________。
a,离子半径A<B
b,电负性A<B
c,单质的熔点A>B
d,A、B的单质均能与某些氧化物发生置换反应
e,A的氧化物具有两性
f,A、B均能与氯元素构成离子晶体
(2)C是地壳中含量最高的元素,C基态原子的电子排布式为_______。
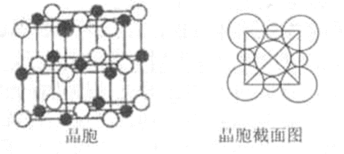
(3)E元素原子的最外层电子数是其次外层电子数的2倍,则乙醇分子中E原子的杂化方式是__________。E的一种单质具有空间网状结构,晶胞结构如右图2。已知位于晶胞内部的4个原子,均位于体对角线的

(4)F与硒元素同周期,F位于p区中未成对电子最多的元素族中,F原子的价电子排布
图为_________;
“>”或“<”“=”
正确答案
答案:
(1)bf (2)1s22s22p4 12 (3) sp3
(4)
解析
略
知识点
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。
(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的




正确答案
答案:
(1)1s22s22p5 (1分)
(2)F>N>O>C (2分)
(3)正四面体(1分) CH4 + 4 Cl2 + 4 HF 
极性(1分) 1:1(或2:2)(1分) 原子(1分)
(4)88.2 kJ(2分)
(5)
(6)4 (1分) 
解析
略
知识点
请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________ ,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:________。解释NH3分子中键角大于H2O中的键角的原因是________。
(3)下列各项的比较中正确的是________。
A.第一电离能:Mg>Al
B.电负性:P>Ge
C.稳定性:AsH3>H2S
D.金属性:20X<30Y
(4)Fe单质的晶体在不同温度下有两种堆积方式,晶胞结构如图所示,面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
正确答案
(1)3d54s1;3d、4s轨道上的电子均为半充满状态
(2) O-H…N N…H-O;NH3分子 中N原子采用sp3杂化后,N原子还有一对孤对电子,而H2O分子 中O原子采用sp3杂化后,O原子有两对孤对电子,对成键电子的排斥作用更强,使键角更小。
(3) AB
(4)1:2
解析
略。
知识点
氮原子核外电子轨道表达式为
正确答案
解析
略
知识点
A、B、C、D是前姆周期原予序数依次增大的四种元素,其中A和B原子的价电子层中朱成对电子均只有1个,并且A-和B+的电子数褶差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)四种元素中第一奄离能最小的是____,电负性最大的是____(填元素符号),C的价电子排布式为____。
(2)A的气态氢化物的熔沸点比下周期阍主族元素气态氢化物高,原因是____。
(3)
(4)D的单质粉末在CO气流中轻微加热,生成无色挥发性液态D(CO)4,基四面体构型。423 K时,D(CO)4分解为D和CO,从而制得高纯度的D粉末。D(CO)4的最体类型是____;推测D(CO)t易溶于下列____溶剂中(填序号)。
a . 乱水 b.四氯化碳 c.苯 d.硫酸镍溶液
(5)据报道,只含碳、镁和D三种元素的晶体具有超导性。该晶体的晶胞结构如下图所示,试写出该晶体的化学式____。晶体中每个镁原子周围距离最近的D原子有____个。
正确答案
解析
(1)K(1分),F(1分), 3d64s2(1分)
(2)HF分子之间可以形成氢键(2分)
(3)离子键、配位键(2分);[FeF6]3-(2分)
(4)分子晶体 (1分) bc(1分)
(5)MgCNi3 (2分) 12(2分)
知识点
下列有关化学用语表达正确的是
正确答案
解析
略
知识点
氮元素可以形成多种化合物。回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,列举一例含2种氮元素化合价的化合物 __________(化学式)。
(2) 肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是 ___________(化学式)。
(3)肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ
若该反应中有4mol N-H键断裂,则形成的气体有______mol,其中转移电子数目 ____。
(4)肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 金属键 d. 范德华力
正确答案
(1)2s22p3 NH4NO3 或 NH4NO2(合理给分)
(2)三角锥形 C2H6
(3)3.5 4NA
(4)cd
解析
略
知识点
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1。由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1。回答下列问题。
(1)该配位化合物X的化学式为 。
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图,其中碳原子的杂化方式有 。
(3)D元素原子的最外层电子轨道表式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5) 元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2), 氰氨化钙和水反应可生成NH3。与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ= g/cm3。
正确答案
(1)Cu(NH3)4SO4`H2O (1分)
(2)sp3杂化和sp2杂化
(3)
(4)H2O与H2O2之间形成氢键
(5)CO2或N2O ; CaCN2+3H2O=CaCO3+2NH3↑
(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
解析
略
知识点
16O和18O是氧元素的两种原子,NA表示阿伏伽德罗常数,下列说法正确的是
正确答案
解析
略
知识点
请考生从给出的3道物理题中任选一题做答。
36.[化学——选修2:化学与技术]
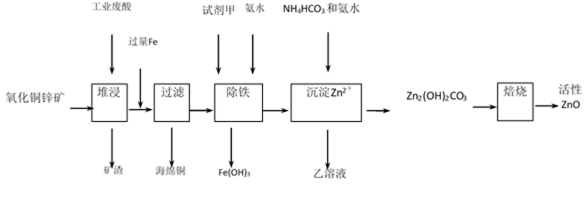
某工厂利用工业废酸(10%H2SO4)堆浸某废弃的氧化铜锌矿制取活性ZnO, 方案如下:
已知:298K时各离子开始沉淀及完全沉淀时的pH:
(1) 氧化铜锌矿中含有少量CuS和ZnS,在稀H2SO4作用下ZnS可溶而CuS不溶,这是由于同温下
Ksp (ZnS) _________Ksp (CuS)(">" “<”,或“=”)。
(2) 在除铁过程中选用下列试剂中的_________作为试剂甲最合适:
A. Cl2
B. HNO3
C. KMnO4
D. H2O2
(3) 除铁过程中加入氨水的目的(),实验中PH应控制的范围();
(4) 加试剂甲后,Fe3+,与氨水生成Fe(OH)3的离子方程式();
(5) 298K时,检验乙溶液中是否残留较多Fe3+的方法();
(6)乙的溶液可直接用作氮肥,乙的化学式();
(7)Zn2(OH)2CO3焙烧的化学方程式()。
37.[化学——选修3:物质结构与性质]
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子云相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)己知A元素扣一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______
(3)己知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。
四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
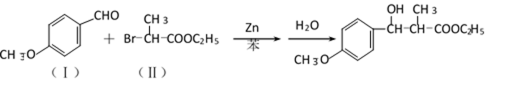
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构, 它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。
若晶体密度为
(用含NA与
38.[化学——选修5:有机化学基础]
有机合成中增长碳链是一个重要环节。如下列反应:
用
(1)(Ⅰ)的分子式为();(Ⅲ)的结构简式为()。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为()。
(3)
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。(Ⅳ)的结构简式为()。
正确答案
见解析。
解析
36.
(1)> (2) D
(3)调节溶液的pH,使Fe3+沉淀完全, 3.2~6.2
(4)Fe3++3NH3·H2O === Fe(OH)3↓+3 NH4+
(5)取少量乙溶液于试管中,滴入几滴KSCN溶液,若出现红色,说明还有较多Fe3+,若无红色出现,说明Fe3+沉淀完全,
(6)(NH4)2SO4
(7)Zn2(OH)2CO3 == 2ZnO+CO2↑ + H2O(2分)
37.
(1)[Ar]3ds1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na,NaOH > H3PO4 >HClO4>H2SO4
(5)12
38.
说明;所有的化学方程式或结构简式写成一般结构简式或键线式同样得分;化学方程式没有注明反应条件或条件错误扣1分,化学式错误和不配平0分,下同。
(1)C8H8O2 ;CH2=CH-COOH
(2)
或
(3) 
取代反应(或酯化反应)
(4)
知识点
请考生从给出的3道化学题中任选一题做答。
36.某工厂利用工业废酸(10%H2SO4)堆浸某废弃的氧化铜锌矿制取活性ZnO, 方案如下:
已知:298K时各离子开始沉淀及完全沉淀时的pH:
(1) 氧化铜锌矿中含有少量CuS和ZnS,在稀H2SO4作用下ZnS可溶而CuS不溶,这是由于同温下Ksp (ZnS) _________Ksp (CuS)(">" “<”,或“=”)。
(2) 在除铁过程中选用下列试剂中的_________作为试剂甲最合适:
A. Cl2
B. HNO3
C. KMnO4
D. H2O2
(3) 除铁过程中加入氨水的目的 ___________ ,实验中PH应控制的范围 ___________ ;
(4) 加试剂甲后,Fe3+,与氨水生成Fe(OH)3的离子方程式 ___________ ;
(5) 298K时,检验乙溶液中是否残留较多Fe3+的方法 ___________ ;
(6)乙的溶液可直接用作氮肥,乙的化学式 ___________;
(7) Zn2(OH)2CO3焙烧的化学方程式 ___________。
37.已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子云相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)己知A元素扣一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)己知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。
四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构, 它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。
若晶体密度为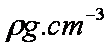
38.有机合成中增长碳链是一个重要环节。如下列反应:
用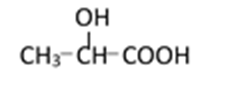
(1)(Ⅰ)的分子式为___________;(Ⅲ)的结构简式为___________ 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为___________ 。
(3)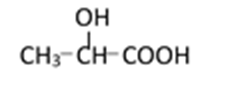
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。(Ⅳ)的结构简式为 ___________。
正确答案
见解析。
解析
36.(1)>
(2) D
(3)调节溶液的pH,使Fe3+沉淀完全, 3.2~6.2
(4)Fe3++3NH3·H2O === Fe(OH)3↓+3 NH4+
(5)取少量乙溶液于试管中,滴入几滴KSCN溶液,若出现红色,说明还有较多Fe3+,若无红色出现,说明Fe3+沉淀完全 ,
(6)(NH4)2SO4
(7)Zn2(OH)2CO3 == 2ZnO+CO2↑ + H2O
37.(1)[Ar]3ds1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na,NaOH > H3PO4 >HClO4>H2SO4
(5)12;
38.(1)C8H8O2 ;CH2=CH-COOH
(2)
或
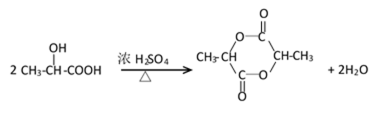
(3) 
取代反应(或酯化反应)
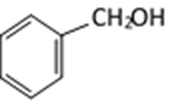
(4) 
知识点
方沸石是常见的似长石矿物,为含水的钠铝硅酸盐。在玄武岩、辉绿岩、花岗岩、片石岩和洞穴中及碱性湖底沉积中会有它们的存在。
(1)方沸石的组成元素中,原子核外电子有3种能量状态的元素是_________(填元素符号),原子核外M层上有2个未成对电子的元素其原子最外层电子排布式是_________。
(2)方沸石的组成元素中,具有相同电子层结构的离子其离子半径由小到大的顺序_________,属于第三周期的非金属元素,与氧元素形成的氧化物属于_________晶体。
(3)元素周期表中与氧元素相邻,且非金属性比氧元素强的是_________(填元素符号),能说明它的非金属性比氧强的1个化学方程式是____________________________________。
正确答案
(1)O 3s23p2
(2)Al3+ <Na+ <O2- 原子
(3)F ;2F2 +2H2O→4HF+O2
解析
略
知识点
符号“3px”没有给出的信息是()
正确答案
解析
略
知识点
其中第29、30题为物理题,第31、32题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
31.[化学----物质结构与性质]
(1)铬的外围电子排布式是( ) ,与铬同周期,最外层有3个未成对电子数的元素名称是( ),该元素对应的最低价氢化物分子的中心原子采取了( )杂化方式,分子的空间构型是( ) 。
(2)富勒烯
(3)氟化氢水溶液中存在氢键有( )种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是( ),锰与X在准晶体中的结合力为 ( )。
32.[化学—有机化学基础]
莽草酸(C7H10O5)可有效对付致命的H5N1型禽流感病毒的药物“达菲”的重要成分,它可从中药八角茴香中提取得到。右图是以莽草酸为原料合成某些物质的路线:
根据上图回答下列问题:
(1)A中含有的两种含氧官能团分别是_____________________
(2)已知烯醇式结构(C=C-OH)不能稳定存在、则莽草酸的结构简式为( ) 。
(3)莽草酸→C的反应类型是( ) 。
(4)写出C→D的化学反应方程式( )。
(5)与C具有相同官能团的同分异构体(含C)共有( )种。
31.[化学----物质结构与性质]
(1)铬的外围电子排布式是 ,与铬同周期,最外层有3个未成对电子数的元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取

(2)富勒烯(


(3)氟化氢水溶液中存在氢键有 种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是 ,锰与X在准晶体中的结合力为 。
32.[化学—有机化学基础]
莽草酸(C7H10O5)可有效对付致命的H5N1型禽流感病毒的药物“达菲”的重要成分,它可从中药八角茴香中提取得到。右图是以莽草酸为原料合成某些物质的路线:
根据上图回答下列问题:
(1)A中含有的两种含氧官能团分别是_____________________
(2)已知烯醇式结构(C=C-OH)不能稳定存在、则莽草酸的结构简式为 。
(3)莽草酸→C的反应类型是 。
(4)写出C→D的化学反应方程式 。
(5)与C具有相同官能团的同分异构体(含C)共有 种。
正确答案
正确答案
扫码查看完整答案与解析