- 电解质溶液的导电性
- 共60题
26.某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙。
(1)试剂A是_________,试剂A需要过量的原因是_______________________。
(2)操作a得到的滤渣的成分是_______________________,在实验室中进行操作a需要的仪器是:铁架台(带铁圈)、滤纸、烧杯、_________、_________。
(3)加入试剂C调节滤液pH的离子反应方程式是_____________________。
(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积,部分装置如下图:
① 碳棒接直流电源的_______极; 铁棒上发生的电极反应为_____________。
② 说明氯气具有氧化性的实验现象是____________________。
③ 将上图中的仪器,连成一整套装置,各种仪器接口的连接顺(填编号)是B接_______,_______接_______。在答题卡的方框中画出与A接口连接的仪器的装置图。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.互为同分异构体的有机物A、B、C的分子式均为C5H8O2,其中A为直链结构,加热时能与新制的氢氧化铜浊液反应,生成砖红色物质;A分子中核磁共振氢谱图中有三组峰,且峰面积之比为2:1:1。B为五元环酯。C的红外光谱表明其分子中存在甲基。A~I等有机物的转化关系如下:
已知:烯烃在一定条件下可与卤素单质发生a—H原子的取代反应。
(1)A、B的结构简式分别是:A___________,B___________。
(2)C为反式结构,其结构式为_____________________。
(3)写出下列反应的化学方程式;
D→C:___________________________。
G→H:___________________________。
(4)写出下列反应类型:
F→G_____________,
A→I中的①_____________。
(5)写出F发生加聚反应生成的产物的结构简式____________。
(6)与A的官能团组成和个数均相同的同分异构体还有________个。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.一个化学反应一般都有旧化学键的破坏和新化学键的形成。在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催化剂的反应历程),下列叙述正确的是( )
①使用催化剂可降低生产能耗
②该反应的热化学方程式为N2(g)+3H2(g) 
③相同状况下,lmol氮气和3mol氢气总能量高于2mol氨气的总能量
④相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.已知钡的某种同位素是
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.以下描述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
22.工业生产纯碱的工艺流程示意图如下:
(1)粗盐水中加入沉淀剂A.B以除去杂质制取精盐(沉淀剂A来源于石灰窑厂),写出B的化学式________________。
(2)向过滤出C后的滤液中通入气体NH3和CO2,则气体M是____________________(填化学式),选择的理由是______________。通入气体N后现象是___________
(3)滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是__________________________。
正确答案
(1)Na2CO3
(2)NH3,NH3极易溶于水且显碱性,有利于CO2的溶解。浑浊
(3)NH4Cl,取样,先加稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀产生,则证明该阴离子是氯离子
解析
解析已在路上飞奔,马上就到!
知识点
19.铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾K2FeO4是一种新型、高效、多功能绿色水处理剂,某化学探究小组设计如下方案制备上述两种产品,请回答下列问题:
(1)若A物质为水,一定条件下可得铁的固体氧化物Fe3O4,检验Fe3O4中铁的化合价,应使用的试剂是 _______ (填标号)。
A.稀硫酸
B.稀硝酸
C.KSCN溶液
D.酸性高锰酸钾溶液
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式 ___________ 。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得K2FeO4。完成并配平下列化学方程式:

该反应中的氧化剂是 _______,每生成1mol K2FeO4转移______mol电子。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
①写出滴定选用的指示剂_______,滴定终点观察到的现象 ____________ 。
②溶液I中铁元素的总含量为____________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会__________(填“偏高”、“偏低”、“不变”)。
正确答案
(1)ACD
(2)6Fe2++ClO3—+6H+=6Fe3++Cl—+3H2O
(3) 1、3、4、2K2FeO4、3、2H2O ;KNO3 3
(4)①淀粉 溶液由蓝色变无色且半分钟不变色
②5.6 偏高
解析
解析已在路上飞奔,马上就到!
知识点
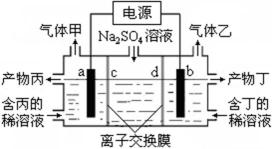
11.工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1︰2,以下说法中正确的是
正确答案
解析
电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,产物丁为氢氧化钠溶液。
A.a极为阳极,与电源的正极相连,A错误;
B.电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,B正确;
C.离子交换膜c为阴离子交换膜,允许氢氧根离子通过, 离子交换膜d为阳离子交换膜,允许氢离子通过,C错误;
D.b电极反应式:2H++2e-= H2↑,D错误。
故选B。
考查方向
解题思路
电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,产物丁为氢氧化钠溶液。
A.a极为阳极,与电源的正极相连;
B.电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液;
C.离子交换膜c为阴离子交换膜,允许氢氧根离子通过, 离子交换膜d为阳离子交换膜,允许氢离子通过;
D.b电极反应式:2H++2e-= H2↑。
易错点
本题考查了电解原理,明确离子放电顺序是解本题关键,根据电极反应式分析解答,题目难度不大。
知识点
4.2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石
正确答案
解析
A.放电时为原电池,铝易失去电子为负极、石墨为正极,A正确;
B.充电时的阳极反应发生氧化反应,失去电子,电极反应式为:Cn+ AlCl4--e-= Cn AlCl4,B正确;
C.放电时,铝易失去电子,负极反应为:Al-3e-+7 AlCl4-=4A12C17- ,C正确;
D.放电时为原电池,有机阳离子向正极移动,即石墨电极方向移动,D错误。
故选D。
考查方向
解题思路
A.放电时为原电池,铝易失去电子为负极、石墨为正极;
B.充电时的阳极反应发生氧化反应,失去电子,电极反应式为:Cn+ AlCl4--e-= Cn AlCl4;
C.放电时,铝易失去电子,负极反应为:Al-3e-+7 AlCl4-=4A12C17-;
D.放电时为原电池,有机阳离子向正极移动,即石墨电极方向移动。
易错点
本题考查了充电电池的相关原理,难度一般,解题的关键是掌握原电池和电解池的原理。
知识点
5.下列有关电解质溶液中粒子浓度关系正确的是( )
正确答案
解析
A.醋酸是弱电解质,醋酸溶液稀释C(H+)减小,但由于电离平衡正方向移动,稀释10倍后pH的变化小于1,b<a+1,A错误;
B.根据物料守恒可知:含等物质的量的NaHSO3和Na2SO3的溶液: 2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)],B正确;
C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:溶液中含有等物质量浓度的NH3·H2O、NH4Cl,氨水的电离大于铵根离子的水解,因此 c(NH4+)>c(Cl-)>C(NH3·H2O)>
D.AgCl的溶度积常数大于AgI

故选B。
考查方向
解题思路
A.加水稀释促进醋酸电离,所以醋酸稀释10倍后,稀释后溶液中氢离子浓度大于原来的1/10;
B.根据物料守恒可知:含等物质的量的NaHSO3和Na2SO3的溶液: 2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)];
C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:溶液中含有等物质量浓度的NH3·H2O、NH4Cl,氨水的电离大于铵根离子的水解,因此 c(NH4+)>c(Cl-)>C(NH3·H2O)>
D.AgCl的溶度积常数大于AgI

易错点
本题考查弱电解质电离、酸碱混合溶液定性判断、pH简单计算等知识点,明确弱电解质电离特点、pH计算方法等知识点即可解答,知道甲基橙、石蕊、酚酞试液变色范围,题目难度不大。
知识点
扫码查看完整答案与解析