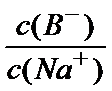- 化学反应速率和化学平衡
- 共523题
7.向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是( )
正确答案
解析
A.a点含有n molNaOH和n molCO32-、b点含有n molCO32-和n molHCO3-,与同浓度盐酸完全反应时,a点消耗盐酸的3n mol,b点消耗盐酸的3n mol,所以A正确;
B.a溶液中含有NaOH,对水的电离产生抑制作用,而b溶液中含有的CO32-和HCO3-,对水的电离程度产生促进作用,所以水的电离程度不相同;
C.a、b两溶液中离子种类都相同,均含有5种离子:Na+、H+、HCO3-、CO32-、OH-;所以都电荷守恒等式均为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) +c(OH-),所以C正确;
D.将a、b两点混合后n molNaOH和n molHCO3-恰好可以完全反应生成CO32-,得到的溶液中只含有Na2CO3,根据Na2CO3溶液的质子守恒等式可以得出c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以D正确。
考查方向
解题思路
向某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,随着CO2的增加,得到Na2CO3的量也逐渐增加,当NaOH消耗完以后,Na2CO3与CO2继续反应生成NaHCO3,所以Na2CO3的量也逐渐减小,
A.a点含有n molNaOH和n molCO32-、b点含有n molCO32-和n molHCO3-,与同浓度盐酸完全反应时,消耗盐酸的体积相同
B.a溶液中含有NaOH,对水的电离产生抑制作用,而b溶液中含有的CO32-和HCO3-,对水的电离程度产生促进作用;
C.a、b两溶液中离子种类都相同,所以都电荷守恒等式相同;
D.将a、b两点混合后溶液得到的溶液中只含有Na2CO3;
易错点
不能准确判断物质成分;不能熟练应用电离平衡知识(电荷守恒、质子守恒)。
知识点
24.氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2+4HCl
完成下列填空:
该反应化学平衡常数K的表达式为 ( );实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是( )反应(填“吸热”或者“放热”)。
上述实验中若压缩体积使压强由P0增大至P1,
在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: ( ) 。
该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)=( )mol。
对该反应达到平衡后,以下分析正确的是 ( )(选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
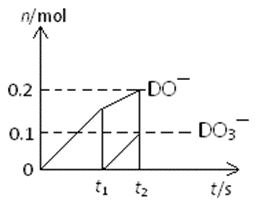
氯元素能形成多种离子。在水溶液中1molCl–、1molClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示)( ) ;若有1.5molB发生反应,转移电子( ) mol。
正确答案
K=[Cl2]2 [H2O]2/([O2][HCl]4) 放热
解析
直接由反应方程式书写化学平衡常数K的表达式为K=[Cl2]2 [H2O]2/([O2][HCl]4;
再由HCl平衡转化率α(HCl)随温度T的变化曲线,得出:温度升高,转化率α(HCl)降低,说明升高温度,平衡逆移,则正反应是放热反应。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
无
正确答案
增大压强,平衡右移,温度相同情况下,转化率增大
解析
若压缩体积使压强由P0增大至P1,即增大压强,平衡正移(正反应是体积减少的反应),则α(HCl)增大。
考查方向
化学平衡及其计算、化学反应热。
解题思路
增大压强,平衡右移,温度相同情况下,转化率增大
易错点
作图
正确答案
解析
该反应在P0、320°C条件下进行,达平衡状态A时,
依据: O2 + 4HCl
始量/mol a 0
变量/mol 4x 2x
A平量/mol a-4x 2x
测得容器内n(Cl2)=7.2×10–3mol,即2x=7.2×10–3mol,4x=14.4×10–3mol,
又知:平衡状态A时,α(HCl)=0.85=14.4×10–3/a,a≈16.94×10–3mol,
则此时容器中的n(HCl)= a-4x =16.94×10–3mol-14.4×10–3mol=2.54×10–3mol。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
无
正确答案
a,d
解析
a.增加n(HCl)的瞬间,正反应速率瞬间增大,故a正确;
b.体积不变加入稀有气体,平衡混合物中各成分的浓度不变,反应速率没影响,且平衡不移动,故b错误;
c.压强不变加入稀有气体,反应体系的体积会增大,相当于减小压强,平衡会向着体积增大的逆反应方向移动,但逆反应速率减小的少于正反应速率,故c错误。
d.该反应正反应放热,如果平衡常数K值增大,则是平衡正向移动,且K只与温度有关,故应该是降温,逆反应吸热,故降温对逆反应的速率的减小更大,d正确。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
平衡状态分析。
正确答案
3ClO–(aq)→2Cl–(aq)+ClO3–(aq)+117 kJ 2
解析
从图示看到B→A+C反应中价态变化关系是:B(+1,60)→A(-1,0)+C(+5,63),得出:3ClO–(aq)→2Cl–(aq)+ClO3–(aq)+117 kJ。若有1.5molB发生反应,转移电子2 mol。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
无
15.常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,实验记录如下表:
正确答案
解析
分析表格数据①HA与等物质的量NaOH溶液反应为恰好反应生成正盐,溶液呈碱性可知盐为强碱弱酸盐②HB与NaOH溶液反应,且酸过量,经过假定强酸验证到PH=2可知该酸为强酸,由此可知A错误,由于HB为强酸,不存在电离平衡和水解平衡,因此温度变化不能改变浓度,故错误。C.根据盐类水解,酸根离子浓度小于钠离子浓度。故选择D正确。
考查方向
解题思路
分析表格数据,根据强弱电解质的特点及结论加以验证
易错点
强弱电解质的判断,PH计算,离子浓度大小比较的规律
知识点
用0.1 mol•L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
21.HX为( )酸(填“强”或“弱”)。
22.N点pH>7的原因是(用化学用语表示)________。
23.下列说法正确的是________(填字母)。a. M点c(HX)<c(X-) b. M点c(Na+)>c(OH-) c. P点c(Cl-)=0.05 mol•L-1
正确答案
(1)弱
解析
(1)读图可知两条曲线上面是HX,下面是盐酸,当HX中加入等体积氢氧化钠时Ph>7,可知HX是弱酸
考查方向
解题思路
本题的解题重点在于读图,能够从图中读出两条曲线上面是HX,下面是盐酸,可知HX是弱酸,当横坐标为10、20ml时两酸的pH变化是不同的,因为生成的NaX是强碱弱酸盐,会发生水解。
易错点
无法从二维图中读出所需数据进行分析
正确答案
(2)X-+H2O
解析
(2)其盐NaX会发生水解,X-+H2O
考查方向
解题思路
本题的解题重点在于读图,能够从图中读出两条曲线上面是HX,下面是盐酸,可知HX是弱酸,当横坐标为10、20ml时两酸的pH变化是不同的,因为生成的NaX是强碱弱酸盐,会发生水解。
易错点
无法从二维图中读出所需数据进行分析
正确答案
(3)b
解析
(3)M点是半体积点,此时溶液中NaX与HX物质的量之比为1:1,pH>7,说明水解程度大于电离程度,因此a错,b 正确,c应该是P点c(Cl-)=(0.1*0.02/0.03) mol·L-1.
考查方向
解题思路
本题的解题重点在于读图,能够从图中读出两条曲线上面是HX,下面是盐酸,可知HX是弱酸,当横坐标为10、20ml时两酸的pH变化是不同的,因为生成的NaX是强碱弱酸盐,会发生水解。
易错点
无法从二维图中读出所需数据进行分析
8.(1)800℃时,某密闭容器中存在如下反应:2NO2(g)
①反应Ⅱ相对于反应I而言,改变的条件可能是____________。
②800℃时,若开始时向容器中同时加入1 mol/LNO、0.2 mol/LO2、0.5 mol/L NO2,则v(正)_____ v(逆)。(填“大于”或“等于”或“”小于“)
(2)己知N2O4(g)
①c( X)代表______(填化学式)的浓度,该反应的平衡常数K= ______ 。(填具体数值)
②前10 min内用NO2表示的反应速率为_________ ,20 min时改变的条件是_________ ;重新达到平衡时,NO2的百分含量_________(填选项前字母)。
a.增大
b.减小
c.不变
d.无法判断
正确答案
(1)① 使用催化剂② 大于
(2)①NO2 K=0.9
② 0.04 mol·l-1·min-1 ;增大NO2浓度 ; b
解析
(1)从图像上可知反应Ⅱ相对于反应I反应速率明显加快,而且产率不变说明平衡未能发生移动,从而判断使用了催化剂。
(2)根据浓度熵与平衡常数的比较,发现Qc<K说明反应向正方向移动。
(3)根据浓度变化量之比等于化学计量数之比可判断X为NO2,10-15分钟浓度均不发生变化判断处于平衡状态,带入平衡常数表达式进行计算。
(4)20min改变条件,从浓度变化不难看出达到平衡的时间需要5min钟,反应速率加快,且X浓度增大,Y的浓度不变,判断改变的条件为增大了浓度。
考查方向
主要考查学生对化学反应速率的计算、影响因素以及勒夏特列原理的应用,同时考查了学生对图表信息处理能力
解题思路
认真分析题目提供的图表信息,根据数据、图像规律联想相关化学反应速率的相关结论并加以验证,能准确的理解勒夏特列原理。
易错点
图表信息的提取如何对应化学反应原理相关结论
知识点
6.室温下,下列电解质溶液叙述正确的是( )
正确答案
解析
25℃时,pH=1的盐酸浓度为0.1mol/L,pH=11的氨水溶液浓度远大于0.001mol/L,故若1 mL pH=1的盐酸与100 mL pH=11的氨水溶液等体积混合后,溶液的pH>7,A项错误;
将0.2 mol·L-1盐酸与0.1 mol·L-1KAlO2溶液混合后会依次发生下列反应:KAlO2+H2O+HCl=KCl+Al(OH)3↓+H2OAl(OH)3+3HCl=AlCl3+3H2O设体积为VL,则混合溶液中的溶质为0.033VmolAlCl3和0.1V molKCl,所以溶液中离子浓度大小关系为c(OH-)<c(H+)<c(Al3+)<c(K+)<c(Cl-) ,B项正确;
pH相等的① NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,由于NH4HSO4中HSO4-也能电离出氢离子,故①中c(NH4+)最小,①②中NH4+的水解不受抑制和促进,pH相等时,两溶液中c(NH4+)相等,C项错误;
由电荷守恒可知,当0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合后,所得溶液中:c(Na+)+c(H+) = c(HCO3-)+2c(CO32-)+c(OH-) ,D项错误。
考查方向
解题思路
把握住物质在水溶液中的电离平衡和水解平衡,分析具体的反应过程。
易错点
本题容易在离子反应的定量计算上出现错误。
知识点
4.在催化剂作用下,H2O2发生分解,其反应能量随反应的进程变化如下图:下列说法正确的是
正确答案
解析
A.化学反应的吸热或者放热根据反应物与生成物的总能量大小判断,从图像中不难看出生成物的总能量小于反应物总能量,所以该反应是放热反应,故错误。
B.根据盖斯定律,反应热只与反应物和生成物的始末状态有关,与途径无关,所以催化剂不能改变反应热,故错误。
C.过氧化氢的分解不是可逆反应,其次催化剂不能影响化学平衡,因此不能改变转化率,故错误。
D.催化剂通过降低活化能加快化学反应速率,故正确。
考查方向
解题思路
认真辨认图形横坐标、纵坐标的意义,以及曲线变化规律、趋势,应用已有的结论加以解释、验证。
易错点
催化剂不能改变平衡,不影响产率
知识点
14.温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)
正确答案
解析
A.由图象可知,10min时到达平衡,平衡时D的浓度变化量为1.5mol/L,故v(B)=1.5/10=0.15mol/(L·min),正确;
B.由图可知,平衡时A、B、D的浓度变化量分别为1.5mol/L、1.5mol/L、3mol/L,故1:1:x=1.5mol/L:1.5mol/L:3mol/L,所以x=2,可逆反应A(g)+B(g)⇌C(s)+xD(g)的平衡常数表达式
C.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,反应前后气体的体积不变,增大压强平衡不移动,错误;
D.由图可知,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变条件应是降低温度,正确;
故选C。
考查方向
解题思路
A.由图象可知,10min时到达平衡,平衡时B的浓度变化量为1.5mol/L,根据
B.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,利用浓度变化量之比等于化学计量数之比计算x的值。化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体不需要写出;
C.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,利用浓度变化量之比等于化学计量数之比计算x的值,增大压强平衡向体积减小的方向移动,据此解答;
D.由图可知,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变条件应是降低温度。
易错点
本题考查化学平衡图象及有关计算、化学平衡影响因素、反应速率计算、化学平衡常数等,难度不大,注意理解外界条件对化学平衡的影响,确定x值是关键。
知识点
部分中学化学常见元素原子结构、性质及用途如下表:
请用化学用语回答下列问题:
(1)按A、B、C顺序,三种元素的金属性逐渐 ;用原子结构解释其原因 。
(2)一定条件下,将4.0 mol FE2和3.0 mol E2 通入到体积为 2 L的密闭容器中。反应达到平衡时,容器中为FE2 0.4 mol ,则此反应的平衡常数是 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 (填字母)。
a.增大压强
b. 降低温度
c.使用催化剂
d. 增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y。
欲探究温度对Y分解速率的影响,应选择 组实验;欲探究Y的浓度对分解速率
的影响,请填写相关数据。
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则t2时刻消耗氢氧化钙质量为 g,此时反应的方程式为 。
正确答案
见解析。
解析
(1)减弱;Na、Mg、Al电子层数相同, 核电荷数的递增,吸引电子能力增强,原子半径逐渐减小,金属性减弱。
(2)135 a d
(3)①和②;2 mL 10% 的H2O2溶液
(4)37g;
知识点
在溶液中,反应A+2B



请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;
③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的
(4)该反应进行到4.0min时的平均反应速度率:
实验②:
实验③:
正确答案
(1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L;
(3)〉;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol(L·min)-1;0.008mol(L·min)-1
解析
(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比达平衡所需时间短,平衡时浓度更小,故不可能是改用催化剂,而只能是升高温度来影响反应速率的
(2)不妨令溶液为1L,则②中达平衡时A转化了0.04mol,由反应计量数可知B转化了0.08mol,所以B转化率为
(3) 

(4)从图上读数,进行到4.0min时,实验②的A的浓度为:0.072mol/L,则△C(A)=0.10-0.072=0.028mol/L,





知识点
扫码查看完整答案与解析