- 化学反应速率和化学平衡
- 共523题
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为__________;
(2)估算该反应的平衡常数__________(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向__________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将__________(填“增大”、“减小”或“不变”),平衡将向__________移动。
正确答案
(1)
(2)
C起 0.09 0 0 0
C变 0.09×
C平 0.06 0.03 0.03 0.03

(3)正反应方向;
(4)增大,正反应方向
解析
略。
知识点
碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式是 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ,计算K1= 。
Ⅱ,根据上述信息判断,温度T1和T2的关系是(填序号)__________。
a.T1>T2
b.T1<T2
c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大c(NO)
b.增大压强
c.升高温度
d.移去部分F
(3)工业上可用焦炭冶炼金属。若0.5 mol碳完全与赤铁矿反应,得到0.6 mol铁,同时生成2种常见气体,则该反应的化学方程式是 。
正确答案
见解析。
解析
(1)C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.6 kJ•mol—1
(2)①
②Ⅰ:9/16
Ⅱ:c
③a b
(3)
知识点
甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)
下表所列数据是反应在不同温度下的化学平衡常数(K)。
(1)判断反应达到平衡状态的依据是
A,混合气体的密度不变
B,混合气体的平均相对分子质量不变
C,生成CH3OH的速率与消耗CO的速率相等
D。CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“
A,加入催化剂 B,充入CO C,充入H2 D,升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c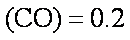
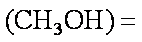
(3)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)

C(s)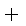

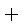
CO(g)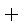

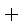
则K1、K2 、K3之间的关系是: 。
正确答案
(1) BD
(2)>、C
(3)0.08 80%
(4) K2=K1·K3
解析
略
知识点
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM25(直径小于等于2.5
请回答下列问题:
(1)将PM25样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM25的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+


写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a。Ca(CH)2 b。Na2CO3 c。CaCl2 d。NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:


若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)
已知该反应的△H
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
。
正确答案
见解析
解析
解析:。
知识点
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
正确答案
答案:
(1)升高温度、降低压强
(2)
(3)
②0.051;每间隔4小时,A的浓度为原来的一半。0.013
解析
(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
平衡浓度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,
(3)

每间隔4小时,A的浓度为原来的一半。
当反应12小时时,C(A)=0.026/2=0.013mol/L
知识点
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:

“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:
(5)已知:2H2 (g) + O2 (g) == 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2
的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用
200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方
程式表示) 。
正确答案
见解析。
解析
(1)小于
(2)80
(3)1
(4)a
(5)2CO(g) + O2(g) === 2CO2(g) △H = -566 kJ/mol
(6)3CO2 + 5OH- === 2CO32- + HCO3- + 2H2O
知识点
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由
空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g) + O2(g) 
2SO2(g) + O2 (g) 
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为________。
② 随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到
平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
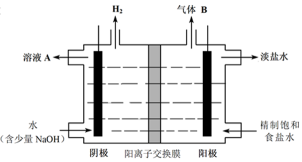
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
① 电解饱和食盐水的化学方程式是 。
② 用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③ 用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
。
正确答案
见解析。
解析
(1) SO2 + H2O = H2SO3 2 H2SO3 + O2 2H2SO4
(2)① NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1
② 减小
(3) ① 2
② b c
(4)① 2NaCl + 2H2O
② SO2 + OH- =HSO3- (或SO2 + 2OH- =SO32- + H2O)
③ SO2 + Cl2 + H2O =4H+ + SO42- + 2Cl-
知识点
27.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积
为100L),在一定条件下发生反应:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.已知A和B在一定条件下可建立如下平衡:2A(g)+B(g)
(1)达到平衡所需时间是I ( ) Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是I( )Ⅱ。
(2)若测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为( )。
(3)计算500℃时该反应的平衡常数,写出计算过程。
(4)t1时刻分别向两容器的平衡体系中加入2 molC,在下列图示中,能正确反映此时两容器中C的体积分数随时间变化曲线的是 ( )(填序号)。
正确答案
(1)>(1分) >(1分)
(2)90%(2分)
(3)K=8100(计算过程略) (2分)
(4)A (2分)
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g)
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
② 该电池工作时,正极是 极(填“a”或“b”);
②该电池负极反应的离子方程式为 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析