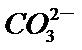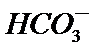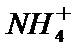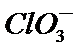- 化学反应速率和化学平衡
- 共523题
3.下列解释事实的方程式不正确的是
正确答案
解析
A.碳酸钠属于强碱弱酸盐,碳酸根离子发生水解,故正确。
B.0.1 mol·L-1氨水因为是弱电解质,不能完全电离,因此PH小于13,故B正确。
C.“84消毒液”的有效成分次氯酸钠,而不是氯酸盐,故C错误。
D.合成氨是一个可逆反应,存在一定的限度,所以不能完全反应,故D正确。
考查方向
解题思路
判断盐类水解的条件及溶液酸碱性,弱电解质的电离特点、氯气的性质及其应用、可逆反应存在限度不能全部转化
易错点
“84消毒液”的有效成分不熟知,弱电解质的电离与PH的关系
知识点
13.25℃时,向100 mL 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )
正确答案
解析
a点时溶液中存在:NH4HSO4=NH4+ +H+ +SO42- 与NH4+ +H2O 


考查方向
解题思路
把握电离与水解的关系,影响溶液导电性的因素,掌握三大守恒的运用。
易错点
电荷守恒运用不当
知识点
4.根据下图所给信息,得出的结论正确的是( )
正确答案
解析
A.由图中信息:1mol的C完全燃烧生成1molCO2(s)时放出热量是bKJ,而燃烧热是生成1molCO2(g)时放出热量,所以碳的燃烧热小于b kJ/mol,故A错误;
B.根据图中信息:C(s) + O2(g) = CO2(s) △H = -bkJ/mol,CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,再根据盖斯定律:(-②)×2得出2C(s) + O2(g) = 2CO(g) △H = -2(b-a) kJ/mol,故B正确;
C.根据图中信息:CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,所以2CO2(s) = 2CO(g)+O2(g) △H = +2a kJ/mol,所以C错误;
D.生成气态CO2释放的能量要小于生成固态CO2释放的能量;根据图中信息:C(s) + O2(g) = CO2(s) △H = -bkJ/mol,所以生成气态CO2释放的能量要小于b kJ/mol,即 △H > -b kJ/mol,所以D错误;
考查方向
解题思路
A.根据图中信息可知,1mol的C完全燃烧生成1molCO2(s)时放出热量是bKJ,而燃烧热是生成1molCO2(g)时放出热量;
B.根据图中信息可知:C(s) + O2(g) = CO2(s) △H = -bkJ/mol,CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,再根据盖斯定律求解;
C.根据图中信息可知CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,所以2CO2(s) = 2CO(g)+O2(g) △H = +2a kJ/mol
D.生成气态CO2释放的能量要小于生成固态CO2释放的能量;
易错点
没有掌握燃烧热的实质,不能准确提取图中相关信息,释放能量越多,△H越小。
知识点
3、常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是( )
正确答案
解析
pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,A、①与②混合,由于平衡常数不变,CH3COOH、CH3COO-浓度均减半,则氢离子浓度不变,混合溶液的pH=3,c(H+)=0.001mol•L-1,故A错误;B、①和④混合后,醋酸过量,溶液中的溶质为CH3COOH和CH3COONa,故c(Na+)<c(CH3COO-)+c(CH3COOH),故B错误;C、②和③混合后,氨水过量,溶液中的溶质是NH3•H2O和NH4Cl,溶液显碱性,故有:c(H+)<c(OH-),根据电荷守恒可知:c(Cl-)<c(NH4+),故有:c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;D.将这四种溶液加水稀释100倍,促进醋酸和一水合氨电离,导致醋酸中氢离子浓度大于盐酸,氨水中氢氧根离子浓度大于氢氧化钠,但酸仍然是酸,碱仍然是碱,所以这四种溶液的pH大小顺序是:③>④>②>①,故D正确.
考查方向
解题思路
pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,A、①与②混合,CH3COOH浓度改变,pH变化;B、①和④混合后,醋酸过量;C、②和③混合后,氨水过量,溶液中的溶质是NH3•H2O和NH4Cl,根据电荷守恒来分析;D、根据酸、碱的相对强弱确定稀释后酸、碱的pH.
易错点
电解质的电离、酸碱混合溶液定性判断等知识点来分析解答,易错选项是B,注意二者等体积混合时,醋酸过量,溶液中的溶质为醋酸和醋酸钠,为易错点.
知识点
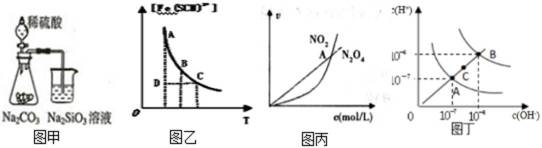
5.下列各示意图与对应表述正确的是()
正确答案
解析
比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱,故A正确;
反应处于D点时,从横坐标看T1温度下对应的平衡状态Fe(SCN)2+浓度比D点高,所以D点还未达到平衡,v(正)>v(逆),故B错误;
乙表示恒温恒容条件下发生的可逆反应2NO2(g)
从A点到C点水的离子积常数是增大的,所以改变的条件应该是升高温度,故D错误。
考查方向
解题思路
A:比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱;
B:反应处于D点时,从横坐标看T1温度下对应的平衡状态Fe(SCN)2+浓度比D点高,所以D点还未达到平衡,v(正)>v(逆);
C:乙表示恒温恒容条件下发生的可逆反应2NO2(g)
D:从A点到C点水的离子积常数是增大的,所以改变的条件应该是升高温度。
易错点
对非金属性强弱比较理解不透彻;对可逆反应及其相关知识理解不透彻;
知识点
11.氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是
正确答案
解析
A.依据判断AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐溶液的pH大于7,故A错误;
B.AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,溶液PH>7;BY的溶液pH=6.溶液呈酸性,所以AY溶液的pH值大于BY的pH,故B错误;
C.BX溶液的pH=4,BY溶液的pH=6,前者水解程度大于后者,加水促进水解,稀释相同倍数溶液pH值变化BX大于BY,故C错误;
D.AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱,BX的溶液pH=4,BY的溶液pH=6.溶液呈酸性,说明HY为弱酸,BOH为弱碱,所以电离平衡常数K(BOH)<K(HY),故D正确
考查方向
弱电解质电离、盐类水解
解题思路
AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱,BX的溶液pH=4,BY的溶液pH=6.溶液呈酸性,说明HY为弱酸,BOH为弱碱,依据判断的结果分析选项判断.
易错点
弱酸阴离子和弱碱阳离子的判断
教师点评
题考查了弱电解质电离、盐类水解,侧重于学生的分析能力的考查,题目难度中等
知识点
急性前壁心肌梗死易发生的心律失常类型为
A.室上性心动过速
B.房室传导阻滞
C.房性期前收缩
D.心房颤动
E.快速室性心律失常
正确答案
E
解析
急性前壁心肌梗死易伴发快速性心律失常,如室性心动过速、频发性、多源性室性早搏等,而下壁心肌梗死易发生缓慢心律失常,如:房室传导阻滞等。故选E.
15.下列图示与对应的叙述相符的是
正确答案
解析
A.滴定开始时0.1 mol•L-1某碱pH<13,所以碱为弱碱,强酸滴定弱碱用甲基橙作指示剂,故A错误;
B.已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件是加入催化剂或前后气体系数不变的反应增大压强,故B错误;
C.由图可知CO(g)+2H2(g)⇌CH3OH(g)△H=419kJ/mol-510kJ/mol=-91kJ•mol-1,故C正确;
D.据金属镁与硫酸反应比铝与稀硫酸反应快,物质的量之比为2:3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)之比为4/9,故D错误;故选C.
考查方向
本题主要考查了中和滴定;反应热和焓变;化学反应速率与化学平衡图象的综合应用;镁的化学性质;铝的化学性质
解题思路
本题考查了图象分析方法,反应特征的应用,主要是反应热量变化,反应定量计算分析判断,中和滴定,题目难度中等.
A.根据盐酸在滴定开始时的pH来判断碱为弱碱,强酸滴定弱碱用甲基橙作指示剂;
B.已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件是加入催化剂或前后气体系数不变的反应增大压强;
C.利用△H=旧键断裂吸收的总能量-新键形成所放出的能量来分析;
D.据金属镁的活泼性大于铝以及镁、铝与足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,即可找出体积(V)与时间(t)的关系.
易错点
1、图象分析方法
2、反应定量计算分析判断
知识点
高铁酸盐在能源、环保等方面有着广泛的用途。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
18.该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn g(已知F=96500 C/mol)。
19.盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
20.图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
21.完成“氧化”过程中反应的化学方程式:
其中氧化剂是 (填化学式)。
22.加入饱和KOH溶液的目的是( )
23.已知25℃时Ksp[Fe(OH)3]=4.0×10。38,此温度下若在实验室中配制Smol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
正确答案
FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;0.2
解析
该电池放电时正极的电极反应式为FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;若维持电流强度为1A,电池工作十分钟,理论消耗Zn 0.2g(已知F=96500 C/mol)。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
右;左
解析
盐桥中盛有饱和KC1溶液,此盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
使用时间长、工作电压稳定。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O;NaClO
解析
Fe元素化合价由+3到+6,Cl元素由+1到到—1,在氧化还原反应中氧化剂和还原剂得失电子总数相等的。2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O故FeCl3、Na2FeO4计量数为2。NaClO和NaCl为3。
考查方向
本题主要考查了电解池电极反应式的书写,氧化还原反应的配平,化工工艺流程。
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
减小高铁酸钾的溶解,促进高铁酸钾晶体析出。
解析
加入饱和KOH溶液的目的是减小高铁酸钾的溶解,促进高铁酸钾晶体析出。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
2.5
解析
K = [Fe3+] / [H+]3分子分母同时乘以[OH-]3,得K = [Fe3+][OH-]3 / [H+]3[OH-]3即K = Ksp / Kw3 = 2.794×10-39 / 10-14 3 = 2794为使配制过程中不出现浑浊现象,则至少需要加入2.5mL 2 mol/L的盐酸。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
扫码查看完整答案与解析