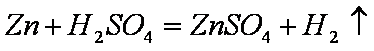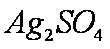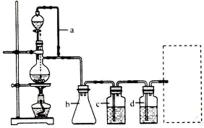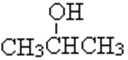- 化学反应速率和化学平衡
- 共523题

8.如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:_______________;
9.有一种用CO2生产甲醇燃料的方法:CO2+3H2
已知:CO2(g)+3H2(g)
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
10.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
①实验2条件下平衡常数K= ________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时
V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。A.CO2减少的化学反应速率和CO减少的化学反应速率相等B.容器内气体压强保持不变C.CO、H2O、CO2、H2的浓度都相等D.容器中气体的平均相对分子质量不随时间而变化
正确答案
(1)SO2-2e-+2H2O=4H++SO42- (2分)
解析
SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+
考查方向
本题考查原电池原理
解题思路
SO2在负极失去电子转化为SO42-,根据电极反应式的书写方法来回答
易错点
根据化合价的变化分析得失电子,对应原电池中的两极反应
教师点评
本题考查原电池原理,是电化学中的重点内容,是高考中的重要考查点,题目难度中等,原电池原理的知识与氧化还原反应的知识交织在一起
正确答案
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O ΔH=-(3/2b+2c-a-d)kJ·mol-1 (2分)
解析
应用盖斯定律解题,△H=-△H1-△H2+



考查方向
本题考查热反应方程式的计算
解题思路
应用盖斯定律解题,始终抓住目标反应和已知反应之间的关系应用数学知识来解
易错点
盖斯定理的计算应用中,注意对方程式做适当的调整
教师点评
本题考查热反应方程式的计算,注意盖斯定理的应用,题目难度中等
正确答案
(3) ①1/6(或0.17) (2分) ΔH<0 (2分) ② >1 (2分) ③ > (2分)④ A
解析
①实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则
③900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol时,浓度商Qc=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆
④A.CO2减少的化学反应速率和CO减少的化学反应速率相等,证明正逆反应速率相等,达到了平衡,故正确;
B.反应前后气体系数和相等,容器内气体压强始终保持不变,所以压强不变的状态不一定平衡,故错误;
C.CO、H2O、CO2、H2的浓度相等,可能平衡也可能不平衡,故错误;
D.容器中气体的平均相对分子质量等于质量和物质的量的比值,质量和物质的量都不变化,所以容器中气体的平均相对分子质量始终不随时间而变化,此时的状态不一定是平衡状态,故错误.
考查方向
本题考查化学平衡计算、化学平衡影响因素、化学平衡状态的判定等
解题思路
①第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;利用三段式计算平衡时,各组分的物质的量,该反应是气体体积不变的反应,故利用物质的量代替浓度代入平衡常数表达式计算平衡常数;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率;
④当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,根据密度和平均相对分子质量的公式进行分析解答该题
易错点
平衡移动后转化率的计算,结合三段式的计算格式进行分析
教师点评
本题考查化学平衡计算、化学平衡影响因素、化学平衡状态的判定等,是高考中的重点考查内容,侧重考查学生对数据的分析及计算能力,注意对知识的理解与掌握,题目难度中等
13.在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )
正确答案
解析
A、如果n=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈碱性,所以n>1,故A错误;
B、b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;
C、c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-)=0.05mol/L,故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)+ c(NH4+)=0.5n,所以c(NH3•H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:
,故D正确
考查方向
本题考查了酸碱混合的定性判断及离子浓度大小比较
解题思路
A、如果n=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈碱性;
B、b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C、c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析解答;
D、25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.05)mol/L,然后结合铵根离子的水解平衡常数表达式计算
易错点
B项电离程度的比较
教师点评
本题考查了酸碱混合的定性判断及离子浓度大小比较, 在近几年的各省高考题中出现的频率较高,常与盐类水解、弱电解质电离、pH计算等知识交汇命题
知识点
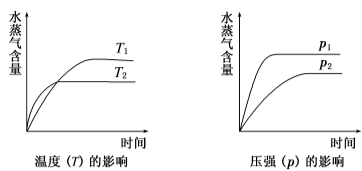
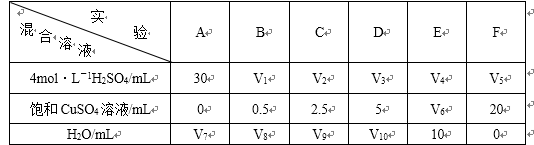
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
正确答案
解析
本题考查化学平衡知识,通过分析图象确定可能对应的反应,观察图象可知,达到平衡用的时间短反应速率快,T2>T1、p1>p2.升高温度水蒸气的百分含量降低,说明平衡逆向移动,反应放热,ΔH<0;增大压强水蒸气的百分含量增大,说明平衡正向移动,正反应气体分子数减少,综合分析A选项中反应符合要求。
知识点
已知分解lmolH2O2放出热量98 kJ.在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I—→H2O+ IO— 慢 H2O2+ IO—→H2O+O2+I—快
下列有关该反应的说法正确的是
正确答案
解析
略
知识点
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题;
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢氯生成速率的原因是
(3)实验室中现在Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集4产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为;当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
正确答案
(1)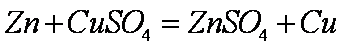
(2)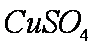
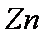
(3)
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等
(5)①30 10 17.5
②灰黑 暗红
③当加入一定量的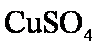
解析
(1)上述实验中发生反应的化学方程式有Zn+CuSO4==ZnSO4+Cu和Zn+H2SO4==ZnSO4+H2。
(2)由于生成了铜,因此已经构成了Zn—Cu原电池,这样便加快了氢气产生的速率。
(3)根据金属活动性顺序表,能与Zn发生置换反应的只有Ag2SO4。
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增大锌粒的表面积等。
(5)①因为生成相同体积的气体,而金属Zn是过量的,则4mol/L H2SO4的体积应相同,所以V1=V2=V3=V4=V5=30mL。又由F可知,溶液的总体积为V5+20 =30+20 =50 mL,因此V6=50 mL-10 mL-30=10 mL;V9=50 mL-2.5 mL-30 mL=17.5 mL。
②由于A中未加入饱和CuSO4溶液,则实验A中的金属呈灰黑色;而E中加入了10 mL的饱和CuSO4溶液,与金属Zn发生了反应生成了单质Cu并沉积在Zn的表面,故实验E中的金属呈暗红色。
③当加入少量CuSO4溶液时,由于构成了Zn—Cu原电池,因而生成氢气的速率会大大提高。当加入一定量的CuSO4后,生成的单质铜会沉积在Zn的表面降低了Zn与溶液接触的表面,使得氢气生成速率反而下降。
知识点
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3= 。
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填“>”、“=”或“<”)。
②在T1-T2及T4- T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是
aNH4Cl
bNa2CO3
cHOCH2CH2OH
dHOCH2CH2NH2
正确答案
见解析。
解析
(1)2△H2—△H1
(2)①<
②T1-T2区间,化学反应未达到平衡,温度越高,反应速率越快,所以CO2被捕获的量随温度的升而提高。T4- T5区间,化学反应已到达平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,所以不利于CO2的捕获。
③
(3)降低温度;增加CO2浓度(或压强)
(4)BD
知识点
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2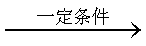
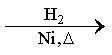
CO的制备原理:HCOOH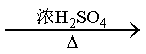
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_________,_________。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是_________,_________。c和d中盛装的试剂分别是_________,_________。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是_________;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)
粗品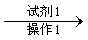


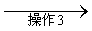
试剂1为_________,操作1为_________,操作2为_________,操作3为_________。
正确答案
(1)Zn+2HCl
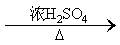
(2)恒压;防倒吸;NaOH溶液;浓H2SO4;分液漏斗、蒸馏烧瓶;
(3)④⑤①②③(或④⑤①③②)
(4)b
(5)饱和NaHSO3溶液;过滤;萃取;蒸馏
解析
(1)实验室用锌粒和稀盐酸制备氢气;用2-丙醇和浓硫酸共热,消去反应制备丙烯;
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯,必须得是反应容器和滴加盐酸的仪器,氢气用向下排空气法收集,注意导气管伸入底部;
(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用③石灰水检验CO2,用②酸性KMnO4溶液检验丙烯,特别注意不能用酸性高锰酸钾溶液除去二氧化硫;
(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率,选b;(5)由操作1后得到“滤液”和信息①可知,试剂1应为NaHSO3饱和溶液,操作为过滤;加入乙醚时1-丁醇易溶解于其中,故操作2为萃取分液;根据两种有机物沸点的不同,操作3应为蒸馏。
知识点
下列描述违背化学原理的是
正确答案
解析
略。
知识点
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)
正确答案
解析
略
知识点
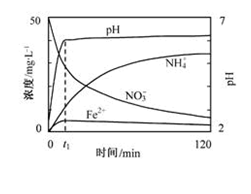
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1H2SO4洗涤Fe粉,其目的是_________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入_________(写化学式)。
(2)上图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式_________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是_________。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:_____________;
假设三:_____________;
……
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO3 -浓度可用离子色谱仪测定)
正确答案
(1)除去铁表面的氧化膜;NO
(2)4Fe+10H++NO3-=Fe2++NH4++3H2O;硝酸根离子在酸性环境下氧化氮氧化物
(3)溶液的温度;使用催化剂
(4)将两份相同的KNO3溶液的pH分别调至2.5和3.5,分别加入等量且足量Fe粉,等反应完成后,用离子色谱仪分别测定溶液中NO3-浓度,如果前者NO3-浓度低,说明酸性越强脱氮速率越快。
解析
略。
知识点
扫码查看完整答案与解析