- 定量实验与探究实验
- 共68题
15.常温下,用0.10 mol·L-1KOH溶液滴定10.00mL 0.10mol·L-1某二元弱酸H2R溶液,所得滴定曲线如图所示。下列叙述正确的是
正确答案
解析
A.a点所示溶液中c(H+)/c(OH-)=c(H+)/Kw=1014 c(H+)2,pH>1,c(H+)/c(OH-)<1012,正确;
B.点c时两溶液恰好完全反应生成了KHR,溶液显酸性,电离大于水解,因此c(K+)>c(HR-)>c(R2-)>c(H2R),错误;
C.点e所示的溶液中,溶质只有K2R,根据电荷守恒和物料守恒可知,c(H+)=c(OH-)-c(HR-)-2c(H2R),错误;
D.五个点中c点时c(HR-)最大,错误;故选A。
考查方向
解题思路
A.a点所示溶液中c(H+)/c(OH-)=c(H+)/Kw=1014 c(H+)2,pH>1,c(H+)/c(OH-)<1012;
B.点c时两溶液恰好完全反应生成了KHR,溶液显酸性,电离大于水解,因此c(K+)>c(HR-)>c(R2-)>c(H2R);
C.点e所示的溶液中,溶质只有K2R,根据电荷守恒和物料守恒可知,c(H+)=c(OH-)-c(HR-)-2c(H2R);
D.五个点中c点时c(HR-)最大,因为溶液的水解和电离程度都较小;
易错点
五个点中c点时c(HR-)最大,因为溶液的水解和电离程度都较小;
知识点
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛

(CCl3CHO)的实验。查阅资料,有关信息如下:
8.仪器A中发生反应的化学方程式是______;装置B中的试剂是_______。
9.若撤去装置C,可能导致装置D中副产物_____(填化学式)的量增加;装置D可采用 加热的方法以控制反应温度在70℃左右。
10.反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________。
11.装置E中可能发生的无机反应的离子方程式有_________________。
13.已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka (CH3COOH)= 1.7×10-5mol·L-1请设计实验证明三氯乙酸、乙酸的酸性强弱。
正确答案
(1)MnO2+4HCl(浓)≜MnCl2+Cl2↑+2H2O,饱和食盐水;
解析
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)≜MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl;故答案为:MnO2+4HCl(浓)≜MnCl2+Cl2↑+2H2O;饱和食盐水;
考查方向
解题思路
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水。
用饱和食盐水除去HCl;
易错点
计算过程要写的清晰,标准。
正确答案
(2)CCl3COOH;水浴;
解析
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O,导致装置D中副产物:CCl3COOH、C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,故答案为:CCl3COOH;水浴;
考查方向
解题思路
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O。控制反应温度在70℃左右,应采取水浴加热。
易错点
计算过程要写的清晰,标准。
正确答案
(3)不可行,CCl3COOH溶于乙醇、三氯乙醛;
解析
(3)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
考查方向
解题思路
(3)CCl3COOH溶于乙醇与CCl3CHO。
易错点
计算过程要写的清晰,标准。
正确答案
(4)Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
解析
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
考查方向
解题思路
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水。
易错点
计算过程要写的清晰,标准。
正确答案
(6)分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性强于乙酸。
解析
(6)分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强;故答案为:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
考查方向
解题思路
(6)酸性越强,电离程度越大,溶液pH越小.
易错点
计算过程要写的清晰,标准。
12.下列实验可达到实验目的的是
正确答案
解析
A.Ca(OH)2和NaHCO3溶液改变滴定顺序,均生成白色沉淀,则不能利用相互滴加检验,故A错误;
B.CH3CH2Br中不含溴离子,与硝酸银不反应,不能检验溴元素,故B错误;
C.溴与二氧化硫发生氧化还原反应,但溴单质和二氧化硫的反应必须在水溶液中进行,则不能用溴的四氯化碳溶液吸收SO2气体,故C错误;
D.卤代烃在NaOH的醇溶液中共热,发生消去反应,则
考查方向
物质的制备、分离提纯和鉴别
解题思路
A.Ca(OH)2和NaHCO3溶液改变滴定顺序,均生成白色沉淀;
B.CH3CH2Br中不含溴离子;
C.溴与二氧化硫发生氧化还原反应,但溴单质和二氧化硫的反应必须在水溶液中进行;
D.卤代烃在NaOH的醇溶液中共热,发生消去反应.
易错点
C项中溴单质和二氧化硫的反应必须在水溶液中进行
教师点评
把握物质的性质、发生的反应及物质检验为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大
知识点
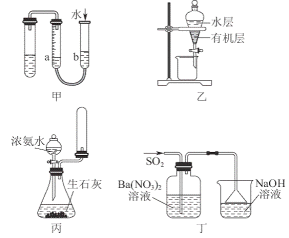
4.用下列实验装置进行相应实验,能达到实验目的的是( )
正确答案
解析
A.能产生压强差的装置能检验装置气密性,该装置调节b装置时能产生压强差,所以可以来检验装置气密性,故A错误;
B.四氯化碳能作溴水的萃取剂且密度大于水,所以图乙可以作为CCl4萃取溴水后的分液装置,故B正确;
C.收集氨气时应该采用向下排空法,且收集时不能将试管口塞塞子,否则收集气体的试管中压强过大易产生安全事故,且导气管深入试管底部,故C错误;
D.二氧化硫能被硝酸钡氧化生成硫酸钡,所以生成的白色沉淀是硫酸钡而不是亚硫酸钡,故D错误
考查方向
化学实验方案评价
解题思路
A.能产生压强差的装置能检验装置气密性;
B.四氯化碳能作溴水的萃取剂且密度大于水;
C.收集氨气时应该采用向下排空法,且收集时不能将试管口塞塞子;
D.二氧化硫能被硝酸钡氧化生成硫酸钡
易错点
C项试管口不能塞塞子
教师点评
本题考查化学实验方案评价,为高频考点,涉及气密性检验、萃取、气体的收集、氧化还原反应等知识点,明确实验原理、物质性质、实验操作是解本题关键
知识点
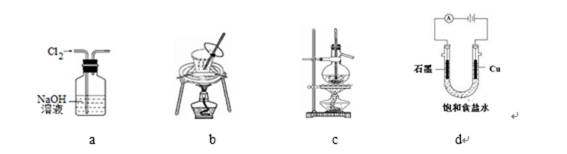
4.用下列实验装置进行相应实验,装置正确且能达到实验目的的是
正确答案
解析
A.氯气和HCl都能和NaOH溶液反应,所以不能用NaOH溶液除去氯气中的HCl,应该用饱和食盐水,故A错误;
B.从溶液中获得NaCl晶体采用蒸发结晶方法,应该用蒸发皿蒸发盛放氯化钠溶液,坩埚用于灼烧固体,故B错误;
C.实验室用浓硫酸作催化剂、170℃条件下加热乙醇制取乙烯,温度计测量混合溶液温度,该装置符合实验要求,故C正确;
D.如果用Cu作电解池阳极,则阳极上Cu失电子而不是电解质溶液中阴离子失电子,所以得不到氯气,应该用石墨作阳极、Cu作阴极,故D错误
考查方向
化学实验方案的评价
解题思路
A.氯气和HCl都能和NaOH溶液反应;
B.从溶液中获得NaCl晶体采用蒸发结晶方法,应该用蒸发皿蒸发盛放氯化钠溶液;
C.实验室用浓硫酸作催化剂、170℃条件下加热乙醇制取乙烯,温度计测量混合溶液温度;
D.如果用Cu作电解池阳极,则阳极上Cu失电子而不是电解质溶液中阴离子失电子
易错点
D项:铜做电解池的阳极,Cu失电子,得不到氯气
教师点评
本题考查化学实验方案评价,为高频考点,涉及电解原理、物质制备、仪器选取、除杂等知识点,明确实验原理及物质性质、实验操作规范性是解本题关键,注意从实验操作规范性、仪器用途、实验评价方面分析解答
知识点
13.常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液,用 pH传感器测得混合溶
正确答案
解析
A.滴定之前碳酸钠溶液的pH=11,所以溶液中氢氧根离子的浓度为0.001 mol/L,该Na2CO3溶液的浓度大于0.001 mol/L,A错误;
B.在pH=7时,溶液显示中性,氢离子和氢氧根离子浓度相等,此时溶液中还含有碳酸根离子和碳酸氢根离子,所以钠离子大于氯离子浓度,B错误;
C.在pH=6时,溶液显酸性,溶液的组成可能是:碳酸氢钠和饱和二氧化碳溶液的混合物,此时c(Na+)>c(HCO3-)>c(CO32-),C正确;
D.根据pH变化曲线,可以看出c到d阶段,随着盐酸的加入,pH基本不再变化,所以该阶段盐酸剩余,碳酸钠和碳酸氢钠完全消耗掉了,D错误。
故选C。
考查方向
解题思路
A.根据滴定之前溶液的pH来计算碳酸钠的浓度;
B.根据电荷守恒以及溶液显示中性时氢离子和氢氧根离子浓度相等来判断;
C.在pH=6时,溶液显酸性,根据溶液的组成情况确定离子浓度的大小关系;
D.根据pH变化图象结合滴定实际来回答。
易错点
本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分是解题的关键,题目难度较大。
知识点
14. 将含有苯胺、水杨酸(邻羟基苯甲酸)、硝基苯、苯酚四种有机物的乙醚溶液,按如下流程用分液漏斗依次分离,假设每一步分离都是完全的。
下列说法正确的是( )
正确答案
解析
略
知识点
扫码查看完整答案与解析