- 定量实验与探究实验
- 共68题
某位同学在查阅资料时发现含氮化合物有以下性质:
①常温下NO2和N2O4混合存在,在低于0℃的过冷水中只有无色的N2O4液体或晶体存在;
②浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成。该同学在验证了“性质①”后又设计了如下装置验证“性质②”,同时测定某电器元件中铜银合金材料的含铜量。实验步骤如下:第一步 检验装置的气密性后加入相关药品;第二步 打开K1,通入氮气一段
回答下列问题:
26.实验前、后都需要打开K1,通入氮气一段时间。“第二步”中通入氮气是为了___________________________;“第四步”中通入氮气是为了____
27.“第三步”的目的是验证“性质②”并确保有害气体被完全吸收,请补全实验步骤并写出能证实“性质②”的预期现象:A中反应结束后,__________
28.实验结束后,通过测量确定装置A烧瓶中溶液的体积为100 mL,装置C增重3.22 g,装置E增重0.54 g(E中N元素均以NO3-的形式存在),不考虑硝酸的挥发与分解以及空气对试剂的影响,则实验所用铜银合金中铜的质量分数为_______(结果保留3位有效数字),实验后装置A烧瓶内溶液中硝酸的物质的量浓度为_______mol·L-1。
29.已知存在可逆反应:Ag+FeCl3

正确答案
排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置C或E吸收
解析
由于第二步要制取NO,而NO容易被氧气氧化;所以通入氮气的目的是为了排尽装置中的空气,防止生成的NO被氧化;反应结束后要使反应所产生的气体完全被吸收,所以在“第四步”中通入氮气是为了保证反应产生的气体完全被装置C或E吸收。故答案为:排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置C或E吸收。
考查方向
解题思路
由于第二步要制取NO,而NO容易被氧气氧化;所以通入氮气的目的是为了排尽装置中的空气,防止生成的NO被氧化;反应结束后要使反应所产生的气体完全被吸收,所以在“第四步”中通入氮气是为了保证反应产生的气体完全被装置C或E吸收。故答案为:排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置C或E吸收。
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
正确答案
打开K2,持续通入氧气,D中出现红棕色气体
解析
“第三步”的目的是验证浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成,并确保有害气体被完全吸收,要验证还有少量NO,就要让NO与O2反应,同时要吸收NO,必须让NO转变为NO2气体才能被碱液吸收,所以实验步骤为打开K2,持续通入氧气,D中出现红棕色气体。故答案为:打开K2,持续通入氧气,D中出现红棕色气体。
考查方向
解题思路
“第三步”的目的是验证浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成,并确保有害气体被完全吸收,要验证还有少量NO,就要让NO与O2反应,同时要吸收NO,必须让NO转变为NO2气体才能被碱液吸收,所以实验步骤为打开K2,持续通入氧气,D中出现红棕色气体。故答案为:打开K2,持续通入氧气,D中出现红棕色气体。
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
正确答案
22.9%;11.7
解析
【解析】装置C增重3.22 g,说明反应生成的N2O4质量为3.22 g,转移的电子为(3.22/92)×2=0.07mol,装置E中NO3-0.54 g,说明浓硝酸与铜、银还生成了NO,而且增加的质量根据反应关系4NO~O2可以知道反应生成了(0.54/38)mol NO,所以转移的电子为(0.54/38)×3=0.042mol,根据电子守恒可以得出如下关系:n(Cu)×2+n(Ag)×1=0.07+0.042。 再根据n(Cu)×64+n(Ag)×108=7,联立方程组求解得出铜银合金中铜的质量分数为22.9%,根据原子守恒,反应结束后实验后装置A烧瓶内溶液中剩余的硝酸为13.5×0.1-n(Cu)×2+n(Ag)×1-0.07+0.042=1.17mol,所以硝酸的物质的量浓度为1.17mol/(0.1L)=11.7mol·L-1。
故答案为:22.9%;11.7。
考查方向
解题思路
装置C增重3.22 g,说明反应生成的N2O4质量为3.22 g,转移的电子为(3.22/92)×2=0.07mol,装置E中NO3-0.54 g,说明浓硝酸与铜、银还生成了NO,而且增加的质量根据反应关系4NO~O2可以知道反应生成了(0.54/38)mol NO,所以转移的电子为(0.54/38)×3=0.042mol,根据电子守恒可以得出如下关系:n(Cu)×2+n(Ag)×1=0.07+0.042。 再根据n(Cu)×64+n(Ag)×108=7,联立方程组求解得出铜银合金中铜的质量分数为22.9%,根据原子守恒,反应结束后实验后装置A烧瓶内溶液中剩余的硝酸为13.5×0.1-n(Cu)×2+n(Ag)×1-0.07+0.042=1.17mol,所以硝酸的物质的量浓度为1.17mol/(0.1L)=11.7mol·L-1。
故答案为:22.9%;11.7。
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
正确答案
反应中产生沉淀的质量
解析
根据反应Ag+FeCl3
考查方向
解题思路
根据反应Ag+FeCl3
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
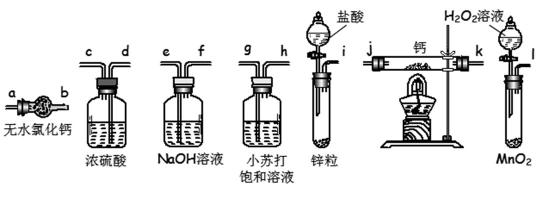
氢化钙固体是登山
请回答下列问题:
8.请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
9.根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;____________________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
10.实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________________
②该同学的判断不正确,原因是_________________________________________
11.请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现___________。
12.登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是______________。
正确答案
i→e,f→d,c→j,k→a或i→e,f→d,c→k,j→a
解析
氢化钙和金属钙都是极强的还原剂,遇水、遇空气都能发生剧烈反应,因此在制取氢化钙时,必须要除去空气、水等其他杂质;在题给的实验装置中,不难判断出氢气的发生装置,氢气的净化装置和氢化钙的生成装置等,其连接顺序为i→e→f→d→c→j→k(或k→j)→a。
考查方向
解题思路
氢化钙和金属钙都是极强的还原剂,遇水、遇空气都能发生剧烈反应,因此在制取氢化钙时,必须要除去空气、水等其他杂质;
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
BADC
解析
为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯→加热反应→停止加热→继续通氢气至冷却→停止通入氢气,故答案为BADC。
考查方向
解题思路
为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
①CaH2+H2O
②Ca也可与水反应产生类似现象
解析
CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2 ,反应方程式分别为:CaH 2 +2H 2 O=Ca(OH) 2 +2H 2 ↑和Ca+2H 2 O=Ca(OH) 2 +H 2 ↑,因此不能根据反应后溶液呈碱性判断是否含有CaH 2 。
考查方向
解题思路
CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
取两种固体,在加热情况下,分别与干燥的氧气作用,将产物气体这过无水CuSO4,若观察到无水CuSO4固体由白色变为蓝色,则为CaH2,不变蓝色者为Ca。
解析
CaH 2 可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色。所以实验方案是取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色。
考查方向
解题思路
CaH 2 可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
CaH2为固体,携带方便。
解析
作为能源,氢化钙明显比氢气更易携带,使用也较方便。所以其优点是氢化钙是固体,携带方便。
考查方向
解题思路
作为能源,氢化钙明显比氢气更易携带,使用也较方便。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
12. 某同学做如下实验

正确答案
解析
A.NO是无色气体、二氧化氮是红棕色气体,Al和稀硝酸反应生成无色的NO,NO不稳定,易被氧气氧化生成红棕色气体二氧化氮,则发生反应2NO+O2=2NO2,故A正确;
B.能使湿润的红色石蕊试纸变蓝色的气体是氨气,根据实验Ⅱ、Ⅲ的气体检验结果及现象知,说明II、III都有NH3产生,故B正确;
C.Al和稀硝酸反应生成NO,其离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O,故C错误;
D.I中生成NO,II、III中生成氨气,I中溶液呈酸性而II和III溶液呈碱性,则在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原,故D正确;
考查方向
化学实验方案的评价
解题思路
A.NO是无色气体、二氧化氮是红棕色气体;
B.能使湿润的红色石蕊试纸变蓝色的气体是氨气;
C.Al和稀硝酸反应生成NO;
D.I中生成NO,II、III中生成氨气
易错点
铝和浓硝酸发生钝化现象,和稀硝酸反应生成硝酸铝和NO
教师点评
本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断及总结归纳能力,明确实验原理及气体性质是解本题关键,题目难度不大。
知识点
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
正确答案
D
解析
铝热反应是指铝与某些金属氧化物(如Fe 2 O 3 、Cr 2 O 3 等)或非金属氧化物(如SiO 2 等)在高热条件下发生的反应.该反应中,镁条为引燃剂,氯酸钾为助燃剂.镁条插入氯酸钾铝与某些金属氧化物或非金属氧化物混合物中.点燃镁条时,镁条燃烧放出足够的热量引发氧化物和铝粉的反应.经引燃后停止加热,反应能进行到底,能说明它是一个放热反应.故A错误.向鸡蛋清溶液中,加入(NH4)2SO4溶液,发生盐析,有沉淀生成,加入蒸馏水沉淀可溶解,故B错误;CaSO4(微溶)与Na2CO3反应生成了更难溶的CaCO3,说明S(CaCO3)<S(CaSO4)B.如果仅仅是这样的话, C是错误的。Na2CO3的溶解度大于NaHCO3 随着反应进行,等物质的量的Na2CO3生成等物质的量的NaHCO3,然而相同的溶剂能恰好溶解Na2CO3,再要溶解等量的NaHCO3便不能了,因此会有部分NaHCO3析出。
考查方向
解题思路
铝热反应是指铝与某些金属氧化物(如Fe 2 O 3 、Cr 2 O 3 等)或非金属氧化物(如SiO 2 等)在高热条件下发生的反应.该反应中,镁条为引燃剂,氯酸钾为助燃剂.镁条插入氯酸钾铝与某些金属氧化物或非金属氧化物混合物中.点燃镁条时,镁条燃烧放出足够的热量引发氧化物和铝粉的反应.经引燃后停止加热,反应能进行到底,能说明它是一个放热反应.故A错误.向鸡蛋清溶液中,加入(NH4)2SO4溶液,发生盐析,有沉淀生成,加入蒸馏水沉淀可溶解,故B错误;CaSO4(微溶)与Na2CO3反应生成了更难溶的CaCO3,说明S(CaCO3)<S(CaSO4)B.如果仅仅是这样的话, C是错误的。Na2CO3的溶解度大于NaHCO3 随着反应进行,等物质的量的Na2CO3生成等物质的量的NaHCO3,然而相同的溶剂能恰好溶解Na2CO3,再要溶解等量的NaHCO3便不能了,因此会有部分NaHCO3析出。
易错点
1、吸放热反应的判定。
2、Ksp的判定。
知识点
6.下列说法正确的是( )
正确答案
解析
A. c(OH-)/c(H+) = 1012的溶液,显碱性,不能大量存在NH4+、Al3+,故A错误;
B.MgO的熔点高,则可以用作耐火材料,故B正确;
C.淀粉和纤维素都可用(C6H10O5)n表示,n不同,则二者不是同分异构体,故C错误;
D.浓氨水中滴加FeCl3饱和溶液发生复分解反应生成沉淀,在沸水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体,故D错误;
考查方向
离子反应;溶液和胶体;同分异构体
解题思路
A.c(OH-)/c(H+) = 1012的溶液,显碱性;
B.MgO的熔点高;
C.淀粉和纤维素都可用(C6H10O5)n表示,n不同;
D.浓氨水中滴加FeCl3饱和溶液发生复分解反应生成沉淀
易错点
Fe(OH)3胶体的制备
教师点评
本题考查离子共存、物质性质和用途等,为高频考点,把握常见离子之间的反应、复分解反应、同分异构体的判断等为解答的关键,注重基础知识的考查,题目难度不大
知识点
7.下列实验装置,试剂选用或操作正确的是
正确答案
解析
A.NO2可与水反应生成硝酸和NO,但又混入水蒸气,故A错误;
B.氯气与浓硫酸不反应,可用浓硫酸干燥,故B正确;
C.容量瓶只能在常温下使用,不能用于稀释、溶解,应在烧杯中溶解且冷却后转移到容量瓶中,故C错误;
D.过氧化钠和水反应剧烈,不能用简易气体发生装置制备氧气,且气体从长颈漏斗逸出,故D错误.
考查方向
化学实验方案评价
解题思路
A.NO2可与水反应生成硝酸和NO,但又混入水蒸气;
B.氯气可用浓硫酸干燥;
C.不能在容量瓶中稀释浓硫酸;
D.过氧化钠和水反应剧烈,不能用简易气体发生装置制备氧气
易错点
A项中混入水蒸气
教师点评
本题考查较为综合,涉及物质分离、提纯以及气体的制备和容量瓶的使用等,综合考查学生的分析能力和实验能力,难度不大,注意相关基础知识的积累
知识点
下列图中的实验方案,能达到实验目的的是
正确答案
解析
略
知识点
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml,浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除


a,KSCN溶液和氯水 b,铁粉和KSCN溶液 c,浓氨水 d,酸性
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
然后加入足量

[探究二]
分析上述实验中

(3)装置B中试剂的作用是 。
(4)认为
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a, A之前 b,A-B间 c,B-C间 d,C-D间
(6)如果气体Y中含有
(7)若要测定限定体积气体Y中


正确答案
(1)铁钉表面被钝化(或其它合理答案)
(2)①d ②66.7%(或其它合理答案)
(3)检验
(4)C+2H2SO4(浓) 
(5)c
(6)D中固体由黑变红和E中固体由白变蓝
(7)否,用托盘天平无法称量D或E的差量 可用分析天平称量D或E的差量
解析
(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能能使铁钉钝化组织反应进一步进行。
(2)+2价亚铁离子能使酸化的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰。选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨。
(3)A除去
(4)C+2H2SO4(浓) 
(5)Q为
(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色。
(7)中学阶段质量的称量选择托盘天平,分度值0.1g,无法精确称量出差量。
知识点
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)
正确答案
解析
由于铅是固体状态,往平衡体系中加入金属铅后,平衡不移动,c(Pb2+)不变;往平衡体系中加入少量Sn(NO3)2固体后,平衡向左移动,c(Pb2+)变大;升高温度,平衡体系中c(Pb2+)增大,平衡向左移动,说明该反应是放热反应,△H﹤0;25℃时,该反应的平衡常数K=
知识点
8.用图所示装置(必要时可加热试管),不能完成的实验是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析