- 烃的衍生物
- 共165题
8.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:
下列分析正确的是
正确答案
解析
A.CPAE中含有1个酯基与2个酚羟基,可与NaOH反应,含有2个酚羟基与1个碳碳双键,可与溴水发生反应,含有苯环与碳碳双键,可与氢气发生加成反应,则1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7mol,正确;
B.咖啡酸分子中,苯环上6个碳原子与6个H原子共面,碳碳双键中的碳取代苯环上的氢原子,则分子中至少有7个碳原子共平面,错误;
C.咖啡酸中含有酚羟基,可与溴水发生取代,与氢气发生加成反应,但不能发生消去反应,错误;
D.CAPE与咖啡酸均含有酚羟基,遇FeCl3溶液均可显紫色,所以不能检测上述反应中是否有CPAE生成,错误;所以答案为A。
考查方向
解题思路
本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、酚、醇等物质性质的考查,选项B为解答的难点,注意酚-OH不能发生消去反应。
咖啡酸不能发生消去反应,CPAE不能发生消去反应,均含苯环可发生加成反应,-OH可发生取代反应;
咖啡酸、CPAE均含酚-OH,均与FeCl3溶液发生显色反应,则不能检验是否有CPAE生成;
含有酚羟基,在邻位和对位发生取代反应,含有碳碳双键,可发生加成反应,则1 mol的咖啡酸最多可与4 mol Br2发生反应;
苯环上所有碳原子处于同一平面上,乙烯中两个碳原子处于同一平面上,咖啡酸中含有苯环碳碳双键,所以所有碳原子可能处于同一平面上。
易错点
1、咖啡酸分子中碳原子共平面的结构分析。
2、含有酚羟基,在邻位和对位发生取代反应,含有碳碳双键,可发生加成反应。
知识点
7.四联苯
正确答案
解析
根据上下对称、左右对称可知,四联苯的等效氢原子有5种,因此四联苯的一氯代物的种类为5种。故选C。
考查方向
解题思路
根据上下对称、左右对称可知,四联苯的等效氢原子有5种,因此四联苯的一氯代物的种类为5种。
易错点
考查有机物的结构、同分异构体数目的确定。根据有机物的结构利用“等效氢”的概念准确判断氢原子的种类是得分的关键。
知识点
9.某有机化合物只含C、H、O 三种元素且只含有一种官能团,其相对分子质量为58,该有机物完全燃烧时产生等物质的量的CO2和H2O。则它可能的结构共有(不考虑立体异构)()
正确答案
解析
该有机物完全燃烧时产生等物质的量的CO2和H2O,故分子中C、H个数之比为1:2,又知只含碳、氢、氧三种元素,相对分子质量为58,故可得出分子式为C3H6O,该有机物只含一种官能团的可能结构请看下表:
考查方向
解题思路
先确定分子式,再推导同分异构体数目。
易错点
遗漏环状结构。
知识点
8.青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
正确答案
解析



考查方向
解题思路



易错点
等效或对称碳原子的数量的判定。
知识点
10.下列说法正确的是 ( )
正确答案
解析
根据有机物的结构简式
B.在碱性条件下,CH3CO18OC2H5的水解产物是乙酸盐,所以B错误;
C.在一定条件下,乙酸、氨基乙酸、蛋白质均含有酸性官能团,能与NaOH发生反应,所以C正确;
D.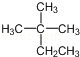
考查方向
解题思路
A.根据有机物的结构简式确定有机化合物的分子式
B.在碱性条件下,CH3CO18OC2H5的水解产物是乙酸盐
C.在一定条件下,乙酸、氨基乙酸、蛋白质均含有酸性官能团,能与NaOH发生反应
D.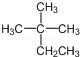
易错点
A.不能准确确定有机化合物的分子式;
B.不了解酯类水解的实质
C.不了解乙酸、氨基乙酸、蛋白质与NaOH发生反应的原理
D.不能熟练掌握和应用有机物的系统命名法
知识点
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯的反应:
其中乙苯在CO2气氛中的反应可分两步进行:
17.上述乙苯与CO2反应的反应热△H=________________________。
18.下列叙述不能说明乙苯与CO2反应已达到平衡状态的是_____________________。
a.恒温恒压时气体密度不变 b.C(CO2) = C(CO)
c.消耗1molCO2同时生成 1molH2O d.CO2的体积分数保持不变
19.在3L密闭容器内,乙苯与CO2发生反应。在三种不同的条件下进行实验,乙苯、CO2的起始浓度均分别为1 mol/L和3 mol/L,其中实验I在T1。C、P1 Pa下,而实验II、III分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图1所示。
①实验I乙苯在0-50min时的反应速率为_______________。
②实验Ⅱ可能改变条件的是__________________________。
③图2是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
20.实验I达到平衡后,在该温度下,向该容器中再通入乙苯和CO2各1mol,重新达到平衡时,乙苯的转化率将 (填“增大”、“减小”或“不变”),此时平衡常数为______________。
正确答案
(1)—210KJ/mol
解析
(1)观察三个热化学方程式,发现已知焓变的A+B可以得到乙苯与二氧化碳的反应,根据盖斯定律,则乙苯与二氧化碳反应的焓变=△H1+△H2=[(-125)+(-85)]kJ/mol=-210kJ/mol;
考查方向
解题思路
(1)根据盖斯定律结合热化学方程式分析;
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
正确答案
(2) b c
解析
②恒温恒压时气体体积发生变化,而质量不变,所以密度不变,说明已达平衡,故a错误;虽然各组分的变化浓度之比等于化学方程式中系数之比,但是各组分的平衡浓度之比不一定等于化学方程式中系数之比,因此二氧化碳和一氧化碳浓度相等时反应不一定达到平衡,故b正确;二氧化碳和水的系数之比等于1∶1,消耗1molCO2同时生成1molH2O,说明不同物质的正反应速率等于化学方程式中系数之比,缺少逆反应速率,因此不能说明达到平衡,故c正确;二氧化碳是反应物,其体积分数逐渐减小,若保持不变,说明反应已达平衡,故d错误;
考查方向
解题思路
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
正确答案
(3)①0.012mol/(L•min) ②加入催化剂 ③ (只要拐点位置正确即可,未标出12.5不扣分)
解析
①观察图I,0~50min内△c(乙苯)=(1.0—0.4)mol/L=0.6mol/L,由于v=△c/△t,则v(乙苯)= 0.6mol/L÷50min=0.012mol/(L•min);
②对比图I、图II,发现I→II时,单位时间内乙苯的变化浓度增大,说明反应速率加快,但是平衡时乙苯的浓度相等,说明平衡没有移动;由于乙苯与二氧化碳的反应是气体体积增大的放热反应,根据浓度、压强、温度和催化剂对化学平衡的影响规律推断,实验II可能改变的条件是加入催化剂;
③同理,推断实验I→III时,反应速率增大,平衡向逆反应方向移动,说明改变的条件是升高温度,因此画出的曲线满足以下几个要点:起点与实验I相同,未达平衡前,实验III的反应速率比I大,平衡后苯乙烯的体积分数比实验I的小;
考查方向
解题思路
(3)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
正确答案
(4)减小 0.375
解析
(4)增大乙苯的浓度,虽然平衡右移,乙苯的变化浓度增大,但是乙苯的起始浓度也增大,且变化浓度增大的程度小于起始浓度增大的程度,因此乙苯的转化率减小;平衡常数只与温度有关,与浓度改变无关,因此实验I中各组分的平衡浓度计算出的平衡常数就是此时的平衡常数,依题意可知实验I反应中各组分的起始、变化、平衡浓度,则:
C6H5CH2CH3(g)+CO2(g) 
起始浓度/ mol•Lˉ1 1.0 3.0 0 0 0
变化浓度/ mol•Lˉ1 0.5 0.5 0.5 0.5 0.5
平衡浓度/ mol•Lˉ1 0.5 2.5 0.5 0.5 0.5
K=[c(C6H5CH=CH2)•c(CO) •c(H2O)]/[c(C6H5CH2CH3) •c(CO2)]="(" 0.5×0.5×0.5)/( 0.5×2.5)=0.375。
考查方向
解题思路
(4)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;若实验I中将乙苯的起始浓度改为1.0mol/L,其他条件不变,因为温度不变,则K不变,根据图I中数据求出K的值.
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
4.对右图两种化合物的结构或性质描述错误的是
正确答案
解析
此题中两种物质所含有的官能团都不一样,前者含有苯环,后者有双键没有苯环,所以它们不是同分异构体,再说前者的分子式是C8H802,后者的分子式是C8H10O2,分子式不同肯定不是同分异构体,所以A对;前者有醛基(醛基具有还原性),后者有双键,两者都能和高锰酸钾发生氧化还原反应使其褪色,所以B错;前者苯环上有两个官能团,会使苯环上更易发生加成反应和取代反应,后者有双键,易发生加成反应,还有羧基,可以和醇发生取代反应,所以C错;核磁共振氢谱可以确定前者醇羟基上的氢与后者羧基上的氢不同,即可鉴别二者,两者所含有的官能团不同,所以可以用红外光谱来区分,所以D错。
考查方向
解题思路
对有机化学选择题,解题是要思路清晰,先找到各个物质的官能团,再找出这两种物质之间的不同点,理解各种官能团的化学性质就可以解决此题
易错点
对官能团不能很好地区分,对某种特定的官能团的性质理解不够透彻,对红外光谱和核磁共振氢谱的用途不清楚就会导致本题出错。
知识点
12.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:
下列说法正确的是
正确答案
解析
A:根据控制单一变量原则,对比I和III,温度增加,反应向正方向进行,故正反应为吸热反应,错;
B:对比I和II,温度相同,但是II的起始的物质的量增加了一倍,在反应后,达到等效平衡时,则不一定I中H2的生成量比II少;错
C:根据控制单一变量原则,此为探究可逆反应达到平衡所需时间与温度之间的关系,当温度升高时,化学反应会变剧烈,反应速度加快,故其他条件相同时,可逆反应会更快达到平衡,错
D:此选项将三种物质的浓度增大一倍相当于将III实验中的体积减少到原来的1/2,增压会导致可逆反应向体积减少的方向进行,正反应反应前1体积气体反应后变为2体积气体,故会导致可逆反应向相反方向进行。
考查方向
影响可逆反应平衡的因素,和控制单一变量原则判断可逆反应的特点
解题思路
根据三组实验,和控制单一变量原则探究可逆反应的特点,I和III比较,温度变化时,升温,可逆反应向正方向进行,故正反应为吸热反应。正反应为1体积的气体生成2体积气体,体积变大,故增压时,反应向逆方向进行,可逆反应达到平衡的时间影响因素中,温度增加反应速度变快,达到平衡的所需时间变短。
易错点
不能运用控制单一变量原则分析可逆反应的特点,前后体积变化情况分析不清
知识点
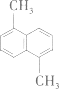
9. 
正确答案
解析
苯环上的二溴代物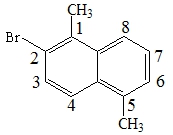
考查方向
解题思路
二溴苯中氢原子的种类等于三溴苯的种类,根据分子中等效氢原子判断。
易错点
本题考查同分异构体的书写,难度中等,根据等效氢判断同分异构体数目,利用对称性确定分子中等效氢原子数目是解题的关键。
知识点
11.某有机物A的结构简式如右图所示,有关叙述中正确的是
正确答案
解析
A.有机物A与浓硫酸混合加热,羟基相邻C上脱不了H原子。
B.1molA中苯环被完全加成。
C.脂基水解后有一个酚生成。
D.有机物A的同分异构体中能在稀硫酸下水解生成二苯酚的有12种
考查方向
解题思路
A.有机物A与浓硫酸混合加热,羟基相邻C上脱不了H原子。
B.1molA中苯环被完全加成。
C.脂基水解后有一个酚生成。
D.有机物A的同分异构体中能在稀硫酸下水解生成二苯酚的有12种
易错点
有机物同分异构体个数的考查
知识点
扫码查看完整答案与解析