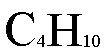- 烃的衍生物
- 共165题
9.乙苯催化脱氢生产苯乙烯的反应:
(1)已知:
计算上述反应的△H=_______ kJ·mol-1。
(2)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表。
① 平衡时,容器中气体物质的量总和为_______mol,乙苯的转化率为________。
②计算此温度下该反应的平衡常数K________。
(3)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用右图表示。[M=n(H2O)/n(乙苯)]
① 比较图中A、B两点对应的平衡常数大小:KA________KB
② 图中投料比(M1、M2、M3)的大小顺序为________。
③某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
正确答案
(1)124;
(2)① 1.4a; 40%;② 4a/15V
(3)① < ;② M1>M2>M3
(4)①②③④
解析
(1)断键2根C-H ,1根C-C;成键1根C=C ,1根H-H上述反应的△H=124kJ·mol-1
(2)总压强变化与物质的量变化成正比,其变化了1.4-1=0.4,则可先假设乙苯转化为xmol通过三段式计算求出容器中气体物质的量总和1.4a,并乙苯的转化率40%。
(3)温度和投料比M对乙苯平衡转化率的影响由图可知,T升高转化率增高得出△H>0。通过图表分析可得知A、B两点对应的平衡常数大小KA<KB 同一个温度下,投料比M=n(H2O)/n(乙苯),乙苯的转化率越高则消耗的 n(乙苯)越多,M越小。图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3。
(4) 该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有CO2与H2反应,使乙苯脱氢反应的化学平衡右移; 不用高温水蒸气,可降低能量消耗; 有利于减少积炭; 有利于CO2资源利用.
考查方向
解题思路
(1)总能量的转化=断键和成键的能量差。CH2CH3
断掉相邻的苯环的支链上断掉C-H 单键,成双键,而苯环等的键不用计算。
(2)pv=nRT,可知压强和物质的量成正比。①总压强变化与物质的量变化成正比,其变化了1.4-1=0.4,则可先假设乙苯转化为xmol通过三段式计算求出容器中气体物质的量总和并乙苯的转化率。
(3)由图可知,T升高转化率增高得出△H>0。通过图表分析可得知A、B两点对应的平衡常数大小。
同一个温度下,投料比M=n(H2O)/n(乙苯),乙苯的转化率越高则消耗的 n(乙苯)越多,M越小。
(4)外界条件对平衡的影响
易错点
1、平衡常数K的计算。
2、外界条件对平衡移动的影响。
知识点
PETG是一种新型材料,可回收利用,对环境不构成任何威胁,其结构简式如下:
已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
试回答下列问题:
23.上述各步反应中,属于取代反应的有__________(填写编号)。
24.写出结构简式:B__________________________、I_________________________。
25.写出化学方程式:
反应④ 、
反应⑤ 。
26.合成时应控制的单体的物质的量n (D)∶n (F)∶n (H)=______________(用m、n表示)。
27.写出同时符合下列要求的物质H的所有同分异构体的结构简式:①属于芳香族化合物且苯环上有两个取代基;②能与NaHCO3溶液反应,并有气体放出;③能发生水解反应。
_______________________________________。
正确答案
②③⑦
解析
由以上分析结合题给转化关系可知②③⑦属于取代反应,①④为加成反应,其他为氧化反应,故答案为:②③⑦
考查方向
解题思路
由以上分析结合题给转化关系可知②③⑦属于取代反应,①④为加成反应,其他为氧化反应,故答案为:②③⑦
易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案

解析
由以上分析可知B为


考查方向
解题思路
由PETG的结构简式可知对应的单体有HOCH2CH2OH、






易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案
解析
反应④的反应为

故答案为:
考查方向
解题思路
由PETG的结构简式可知对应的单体有HOCH2CH2OH、







易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案
m:n:(m+n)
解析
合成时应控制的单体的物质的量n (D):n (F):n (H)=m:n:(m+n),
故答案为:m:n:(m+n)
考查方向
解题思路
合成时应控制的单体的物质的量n (D):n (F):n (H)=m:n:(m+n),
故答案为:m:n:(m+n)
易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案
解析
H为


考查方向
解题思路
H为
易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
19.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液,则该反应的化学方程式为 。
20.天然气的一个重要用途是制取H2,其原理为:CO


压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”);写出X点对应温度下的该反应的平衡常数计算式K= (不必计算出结果)。
21.以二氧化钛表面覆盖CuAl2O4 为催化剂,可以
将CH4 和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率
如图2所示。在275~400℃之间,乙酸的生成速率先降低后升高的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是(写一条) 。
③乙酸(用HAc表示)电离方程式为HAc

正确答案
2NH4HS+O2=2NH3·H2O+2S↓
解析
H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液,则该反应的化学方程式为2NH4HS+O2=2NH3·H2O+2S↓。
考查方向
解题思路
根据三个热化学反应方程式运用盖斯定律即可写出所要求的热化学反应方程式
;不要弄混了反应物和产物,缺什么补什么,然后配平化学反应方程式, 对于CO

易错点
盖斯定律和热化学反应方程式的焓变值的计算错误,化学反应方程式的书写错误和可逆反应中化学平衡移动的影响因素和化学平衡常数的理解不清楚,未能有效从图表中提取有效信息。
正确答案
> > 
解析
天然气的一个重要用途是制取H2,其原理为:CO


计算过程为:CO

起始(mol/L) 0.1 0.1 0 0
变化(mol/L) 0.08 0.08 0.16 0.16
平衡(mol/L) 0.02 0.02 0.16 0.16
则K=(0.16)2·(0.16)2÷0.02·0.02=(0.16)4÷(0.02)2
考查方向
解题思路
根据三个热化学反应方程式运用盖斯定律即可写出所要求的热化学反应方程式
;不要弄混了反应物和产物,缺什么补什么,然后配平化学反应方程式, 对于CO

易错点
盖斯定律和热化学反应方程式的焓变值的计算错误,化学反应方程式的书写错误和可逆反应中化学平衡移动的影响因素和化学平衡常数的理解不清楚,未能有效从图表中提取有效信息。
正确答案
①温度在275o升至300 oC时,达平衡后催化剂催化效率降低的因素超过了
温度升高使速率增大的因素,所以乙酸生成速率降低;当温度由300o升至400 oC时,温度升高使反应速率增大的因素超过了催化剂催化效率降低的因素,所以乙酸的生成速率又增大; ②增大压强,或增大CO2的浓度 ③KW/Ka
解析
以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4 和CO2直接转化成乙酸。 ①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。在275~400℃之间,乙酸的生成速率先降低后升高的原因是温度在275o升至300 oC时,达平衡后催化剂催化效率降低的因素超过了温度升高使速率增大的因素,所以乙酸生成速率降低。
②为了提高该反应中CH4的转化率,可以采取的措施是增大压强,或增大CO2的浓度。
③乙酸(用HAc表示)电离方程式为HAc


考查方向
解题思路
根据三个热化学反应方程式运用盖斯定律即可写出所要求的热化学反应方程式
;不要弄混了反应物和产物,缺什么补什么,然后配平化学反应方程式, 对于CO

易错点
盖斯定律和热化学反应方程式的焓变值的计算错误,化学反应方程式的书写错误和可逆反应中化学平衡移动的影响因素和化学平衡常数的理解不清楚,未能有效从图表中提取有效信息。
正确答案
解析
工业上可用煤制天然气,则CO与H2反应生成CH4(g)和H2O(g)的热化学方程式由(②+③)-①,最后的结果为CO (g)+3H2(g)===CH4(g)+ H2O(g) ΔH=-203kJ·mol-1
考查方向
盖斯定律和热化学反应方程式的考查,化学反应方程式的书写的考查和可逆反应中化学平衡移动的影响因素和化学平衡常数的考查,根据图表信息获取信息完成推断的能力的考查
解题思路
根据三个热化学反应方程式运用盖斯定律即可写出所要求的热化学反应方程式
;不要弄混了反应物和产物,缺什么补什么,然后配平化学反应方程式, 对于CO2(g)+CH4(g)
易错点
盖斯定律和热化学反应方程式的焓变值的计算错误,化学反应方程式的书写错误和可逆反应中化学平衡移动的影响因素和化学平衡常数的理解不清楚,未能有效从图表中提取有效信息。
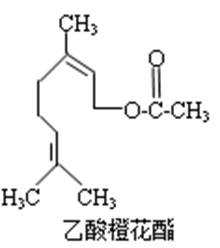
6. 乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中不正确的是()
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
正确答案
解析
①根据有机物的结构可知,其分子式为C12H20O2,故正确;
②该分子中含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性KMnO4溶液褪色,也能使溴水褪色,故错误;
③该分子中含有碳碳双键和酯基,所以能发生加成、取代、氧化、加聚反应,故正确;
④乙酸橙花酯的不饱和度为3,而芳香族化合物至少含有一个苯环,不饱和度至少为4,不存在属于芳香族化合物的同分异构体,故错误;
⑤1mol该有机物水解只能生成1mol羧基,所以只能消耗1molNaOH,故正确;
⑥该分子中含有两个碳碳双键能与氢气发生加成反应,酯基不能与氢气发生加成反应,所以1mol该有机物在一定条件下和H2反应,共消耗H2为2mol,故错误。
故选C。
考查方向
解题思路
①根据有机物的结构确定分子式;
②含有碳碳双键,具有烯烃的性质;
③该分子中含有碳碳双键和酯基,所以能发生加成、取代、氧化、加聚反应;
④乙酸橙花酯的不饱和度为3,而芳香族化合物至少含有一个苯环,不饱和度至少为4;
⑤酯基与氢氧化钠反应;
⑥碳碳双键与氢气发生加成反应,酯基不能与氢气发生加成反应。
易错点
本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查烯烃、酯的性质,题目难度不大。
知识点
6.白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图。下列有关白屈菜酸的说法中,不正确的是
正确答案
解析
分子中不存在酯基,不能发生水解,有双键可以加成,有羧基可以缩聚。
考查方向
解题思路
能发生加聚反应必须具有不饱和键,能发生水解的有酯基肽键卤原子等
易错点
官能团性质易混淆,该环不是苯环,分子中没有酯基
知识点
下列关于乙醇的说法不正确的是
正确答案
解析
略
知识点
下列冠以有机物的叙述正确的是
正确答案
解析
由于乙烯能使溴的四氯化碳溶液褪色而甲烷不能,B项正确;乙醇能与金属钠发生取代反应,乙醇和乙酸的酯化反应也是属于取代反应,A错误;C4H10比只有两种同分异构体,C错误。氨基酸不是高分子化合物,D错误。这题是有机基础题。
知识点
下列有关溶液的叙述正确的是
正确答案
解析
略。
知识点
下列实验“操作和现象”与“结论”对应关系正确的是
正确答案
解析
向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A项错误。应加入碱将水解后的淀粉溶液调节成碱性,才可以产生红色沉淀,B项错误。乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,也可以使酸性KMnO4溶液褪色,C项错误。饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,D项正确。
知识点
下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是
正确答案
解析
本题通过物质的除杂实验操作考查有机化学知识,意在考查考生分析、实验能力。A项苯酚与溴水生成的三溴苯酚仍溶于苯中,无法通过过滤除去杂质,A项错误;乙醇与水互溶,B项操作溶液不分层,无法通过分液达到分离、提纯目的,B项错误;乙醛与水互溶,C项操作溶液不分层,无法通过分液达到分离、提纯目的,C项错误;乙酸乙酯不溶于Na2CO3溶液,而乙酸与Na2CO3溶液作用转化乙酸钠而进入水相从而与乙酸乙酯分离,D项正确。
知识点
扫码查看完整答案与解析