- 气体的收集
- 共20题
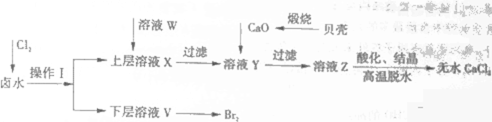
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水无水CaCl2和Br2,流程如下:
(1)操作Ⅰ使用的试剂是_______,所用主要仪器的名称是_______。
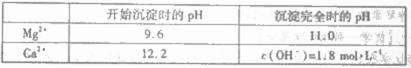
(2)加入溶液W的目的是_______。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择pH最大范围是_______。酸化溶液Z时,使用的试剂为_______。
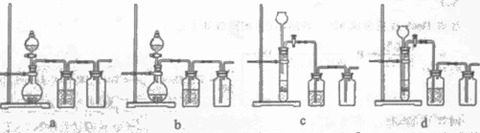
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是_______。
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2, Ka2=6.3×10-3,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。
某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于_______。
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论):_______。
(仪器自选。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。)
正确答案
(1) 四氯化碳;分液漏斗
(2)除去溶液中的SO42-;11.0≤pH<12.2;盐酸
(3)b、d
(4)用于比较pH的两种酸的物质的量浓度不相等;
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHCO3和NaHSO3溶液,用酸度计(或pH试纸)测两种溶液的pH。前者的pH小于后者,证明H2SO3的酸性比H2CO3强。
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水。品红溶液不褪色、且澄清石灰水变浑浊,证明H2SO3的酸性比H2CO3强。
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液。品红溶液不褪色,证明H2SO3的酸性比H2CO3强。
解析
(1)通入氯气后Cl2 + 2Br- =2Cl- +Br2,故操作Ⅰ是萃取,用的仪器是分液漏斗;又因下层得到的是溴,故使用的萃取剂是四氯化碳。
(2)因为加入CaO的目的是除去Mg2+,故加入W的目的是除去SO42-;为了不使Ca2+沉淀,pH的理论值为11.0≤pH<12.2;酸化时,为不引人新的杂质离子,应选用盐酸。
(3)装置的选择,应从发生装置,除杂装置和收集装置三个方面分析。a中收集方法不对; c中的长颈漏斗应插在液面以下;b、d是合理的。
(4)要通过测pH判断两种酸的酸性强弱,两种酸的浓度必须是相等的,而SO2的溶解度远大于CO2的,两饱和溶液的浓度不相等,故该实验的设计是错误的。
验证酸性强弱,最常用的原理是强酸置换弱酸,故
实验步骤:将SO2通入NaHCO3溶液中,生成的气体再通过酸性高锰酸钾除去过量的SO2,再用品红溶液检验SO2是否除尽,最后通入饱和石灰水中。
实验现象:品红不褪色,饱和石灰水变浑浊。
实验结论:H2SO3的酸性比H2CO3强。
知识点
下列实验操作不正确的是
正确答案
解析
略
知识点
下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是
正确答案
解析
略
知识点
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
① 列收集Cl2的正确装置时 。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2) 能量之间可以相互转化:点解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
① 完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
② 甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
正确答案
(1)
①C
②Cl2、HClO、ClO- ③用胶头滴管向试管中滴加溴化钠溶液、震荡使其充分反应,发现溶液出现分层现象,下层溶液变为橙红色。
(2)
①
②电极逐渐溶解;
③装置甲,可以避免铁和铜离子的接触,从而避免能量损失,提高电池效率,提供稳定电流;
(3)Zn。
解析
本题考查化学实验基本操作、非金属性的比较、电化学原理(原电池和电解池)等知识。(1)①氯气的密度比空气大,应采用向上排空气法,氯气有毒,必须有尾气处理装置,故只有C合适;②氯气溶于水后有一部分生成了具有强氧化性的HClO,故溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-三种;③比较Cl2和Br2的氧化性可以通过两种单质之间的置换反应来实现。(2)①根据电子的流向可知,左边的烧杯中的电极为负极,右边烧杯中电极为正极,在原电池中活泼金属做负极,故左边烧杯中盛有ZnSO4溶液,插入锌片,右边烧杯中盛有CuSO4 溶液,插入铜片;②由所给的电极材料可知,当铜片做电极时,铜片一定是正极,则负极是活泼的金属(失电子发生氧化反应),反应的现象是电极逐渐的溶解;③以Fe和Cu做电极为例,如果不用盐桥则除了电化学反应外还发生Fe和铜的置换反应,反应放热,会使化学能以热能的形式转化掉,使其不能完全转化为电能,而盐桥的使用,可以避免铁和铜离子的接触,从而避免能量损失,提高电池效率,提供稳定电流;(3)根据牺牲阳极的阴极保护法,可知被保护的金属作阴极,即Zn作为阳极。
知识点
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3 与稀硫酸反应的离子方程式为 。
(2)加入H2O2 氧化时,发生反应的化学方程式为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液
b.Na2CO3 溶液
c.稀硝酸
d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
正确答案
见解析。
解析
(1)MgCO3+2H+===Mg2++CO2↑+H2O
(2)2FeSO4+H2O2+H2SO4=== Fe2(SO4)3+2H2O
(3)Fe(OH)3
(4)①CO ② d ③3S+6OH-
知识点
扫码查看完整答案与解析