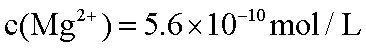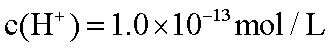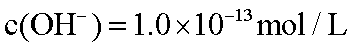- 化学综合计算
- 共266题
28.1L某混合溶液,可能含有的离子如下表:
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为( ) 。
(3)V1 、V2、 V3、 V4之间的关系 ( ) 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.实验探究题
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: Fe3+ > Br2, 因此上述实验现象不是发生化学反应所致, 则溶液呈黄色是含 ( )(填化学式)所致。
②乙同学认为氧化性: Br2 > Fe3+, 因此上述实验现象是发生化学反应所致, 则溶液呈黄色是含 ( )(填化学式)所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 ( )。
②在100mL FeBr2溶液中通入22.4L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 ( )mol/L。
正确答案
(2)①Br2②Fe3+
(3) d , 溶液呈血红色; b , CCl4层呈无色。
(4)①2Fe2++Br2=2Fe3++2Br- ②1.2mol/L
解析
解析已在路上飞奔,马上就到!
知识点
26. 已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
(1)若条件①为点燃,目前60%的金属单质B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,气体D的电子式为:_______;常压下,其沸点比H2O_______(填“高”或“低”);物
(2)若条件①为加热,E是一种两性氢氧化物,请写出该物质的酸式电离方程式:
_______________:气体D是一
(3)若条件①为常温,B和D为同一种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的浓溶液在加热条件下反应的化学方程式:_____________________。
标准状况下,将一充满C气体的试管,倒扣于水中,至液面不再升高时,再充入氧气可以使液面继续上升至充满试管。最终试管中所得溶液的浓度为____________mol/L。(假设试管中溶质不扩散)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列各表述与示意图一致的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.向1LAlCl3 和FeCl3的混合溶液中加入含a mol NaOH的溶液时,产生的沉淀可达到最大值;继续加入NaOH的溶液,沉淀开始溶解,当前后加入的NaOH的物质的量达到b mol时,沉淀量不再变化。求原溶液中Fe3+的物质的量浓度。
正确答案
因为
依题意得
解得
解析
解析已在路上飞奔,马上就到!
知识点
13. 已知298K时,Mg(OH)2的溶度积常数为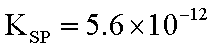
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.超细碳酸钙,粒径范围为1—100nm,其应用非常广泛。下图为某化工企业生产超细碳 酸钙的工业流程图:
供选择的药品:①石灰石②氯化铵③氢氧化钙④饱和氯化钙溶液⑤浓硫酸⑥6 mol/L盐酸⑦饱和食盐水⑧饱和NaHCO3溶液。
试回答以下问题:
(1)装置C中的发生反应的离子方程式为( )。
(2)打开分液漏斗活塞与点燃酒糟灯,在实验中应该先行操作的为( )(填“前者”或“后者”)。
(3)过滤洗涤烘干出C中的碳酸钙固体,设汁实验验证产品是否为超细碳酸钙?( ) 。
(4)该装置逛可模拟侯氏制碱法,则在(装置中产生的沉淀酌化学式为( ) 。
(5)写出E中发生的化学反应方程式( ) 。F试管中的现象为无色溶液先出现沉淀,一段时间后沉淀重新溶解,F中反应漪所装的溶液可能为( )。
(6)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收。另一个作用和图I装置中的一个设计作用相同,请写出图l中相同作用的设计( ) 。
(7)精制工业氯化钙溶液通常方法为加入少量石灰乳除去杂质Mg2+,方程式为:

已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:( ) 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将( )(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 ( )。图中t3时改变的条件可能是 ( ) 。
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
①写出甲中通入甲醇这一极的电极反应式( ) 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式( ),原混合溶液中NaCl的物质的量浓度为 ( )mol/L。(假设溶液体积不变)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。实验 室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境。某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮。有关物质信息、实验流程及实验装置如下:
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g (31℃)。

回答下列问题:
(1)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 ( )。
(2)加入饱和NaHSO3溶液时发生的主要反应是( ) (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是(
)。
(3)为将馏出液的pH调至中性,可以加入的试剂是( ) 。
(4)调节pH后还需加入精制食盐,其目的是( ),“取有机层”时使用的主要仪器是( ) 。(填下图对应的字母)。
(5)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有( )(填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)物质B的电子式为( );图1中反应①的化学方程式是( ) 。
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是( )(填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l mol甲和2 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,则用甲表示的化学反应速率为( ) 
(5)若对(4)中的1 mol甲和2 mol C的混和气体分别只改变一个实验条件(温度、压强、催化剂)后,得到D的物质的量随时间的变化曲线①和②(如图3所示),则曲线①、②所改变的具体实验条件分别是:① ( );② ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.对于常温下pH为4的醋酸溶液,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.毒胶囊事件中,利用皮革废料制成药用胶囊,导致铬超标。铬是人体必需的微量元素。三价铬是对人体有益的元素,而六价铬是有毒的。
实验一:工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO使六价铬转化为三价铬。实验室中模拟这一过程的装置如下图。
请回答以下问题:
(1)装置A除了能制备CO外,该装置还能用于( )气体的制备(举一例)。
(2)装置B的作用是( )。
(3)写出装置C中反应的化学方程式 ( )。
(4)实验结束时熄灭酒精灯的顺序是________________(填写装置序号)。
(5)该装置一个显著的缺陷是( )。
实验二:重铬酸钾(K2Cr2O7)常用于测定废水中Ba2+浓度,步骤如下:
①取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;
②过滤、洗涤后,用适量稀盐酸溶解.此时BaCrO4全部转化为Cr2O72-;
③再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。
部分反应的离子方程式为:
请回答:
(6)取25.00mL废水时,使用的仪器是( )
A.50mL量筒 B.100mL烧杯 C.酸式滴定管 D.碱式滴定管
(7)该废水中Ba2+的物质的量浓度为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 _____,原因是 _____(写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 ______。
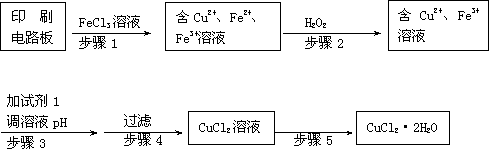
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
①步骤2中反应的离子方程式是________ 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为_______
④步骤3中可选用的“试剂1”是________ (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 ________ [Ksp(Fe(OH)3)=4×10-38]。
正确答案
Ⅰ
湿法炼铜(或方法二) 不会产生污染空气的气体(或湿法炼铜不需要外界提供能量) 3:2
Ⅱ
① 2Fe2++ H2O2 + 2 H+ = 2Fe3+ + 2H2O
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O 
③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。
④ CuO[或Cu(OH)2] 4×10-8mol/L
解析
解析已在路上飞奔,马上就到!
知识点
26.某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:

(1)步骤(a)中,实验研磨孔雀石的仪器名称( );用硫酸浸取的化学方程式:( )
(2)步骤(b)中,pH控制在3.O~3.5,其目的是( );加过氧化氢发生反应的离子方程式为 ( )。
(3)怎样判断蒸发浓缩已完成:( ) 。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表:
写出212~248℃温度范围内发生反应的化学方程式( )。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为( )mol·L-1。
正确答案
(1)研钵 Cu(OH)2·CuC03+2H2S04=2CuS04+3H20+C02↑
(2)使Fe3+沉淀完全,而Cu2+仍留在母液中 2Fe2++H202+2H+=2Fe3++2H2O
(3)当液面有晶体析出时即可说明蒸发浓缩已完成
(4)
(5) 4×lO一6
解析
解析已在路上飞奔,马上就到!
知识点
13.已知常温下Mg(OH)2的Ksp=1.8
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析