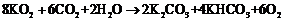- 化学综合计算
- 共266题
homeland
正确答案
12. 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S203·5H20装置和部分操作步骤如下。
Ⅰ.打开K1 关闭K2,向圆底 烧瓶中加入足量浓硫酸加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液经过______、______、过滤、洗涤、烘干,得到产品Na2S203.5H20。
回答下列问题:
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因( )(用离子方程式表示)。
②IV中,操作步骤是______、______。
③装置B中盛放的试剂是(填化学式)( )溶液。
(2)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时

部分反应离子方程式为:
①

①判断达到滴定终点的现象是______________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为( )ml
③废水中Ba2+的物质的量浓度__________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol·L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是( )
正确答案
解析
本题只有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题得0分,若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
知识点
27.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验:
(1)F装置的烧杯中发生反应的离子方程式是( );B装置中的现象是( )。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是( )
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是( )
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是( )
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用0.36 mol·



(已知
正确答案
(1)
(2)D装置中黑色固体颜色无变化,E装置中溶液的红色褪去
(3)拉起钢丝,关闭K1、K2
(4)将A装置中试管内冷却后的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,边倒边搅拌,观察是否有蓝色出现。
(5)5:4
(6)90%
解析
解析已在路上飞奔,马上就到!
知识点
13.已知:常温下浓度为0.1mol/L的下
正确答案
解析
A.根据生成NaF所对应的酸为HF,生成NaClO所对应的酸为HClO,生成Na2CO3所对应的酸为HCO3-,生成NaHCO3所对应的酸为H2CO3,酸性:HCO3-<HClO <H2CO3<HF,所以,三种酸溶液的导电能力顺序:HClO<H2CO3<HF,错误;
B.0.1 mol·L -1 Na2CO3溶液中,c(Na+) = 0.2 mol·L-1 ,将CO2通入0.1 mol·L -1Na2CO3 溶液中至溶液中性,此时CO2过量,反应生成了NaHCO3,此时,溶液的体称没有变,溶液中的钠离子的浓度仍然为:c(Na+)=0.2 mol·L -1,根据电荷守恒有:c(Na+) +c(H+) =c(HCO3ˉ) + 2c (CO32ˉ )+ c(OHˉ),由于溶液呈中性:c(H+) = c(OHˉ),则c(Na+) = 2c (CO32ˉ)+ c (HCO3ˉ)= 0.2mol·L -1 ,错误;
C..NaClO(aq)与NaF(aq)中电荷守恒式分别为c(Na+)+c(H+)=c(ClO-)+c(OH-)、c(Na+)+c(H+)=c(F-)+c(OH-),由于NaClO水解程度大,因此有c(H+)NaClO<c(H+)NaF,所以NNaClO<NNaF所以C正确;
D.向Na2CO3 溶液中通入少量HF气体Na2CO3+ HF =NaF+ NaHCO3,故D不正确。
考查方向
解题思路
相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32ˉ >ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3ˉ<HClO<HF
易错点
不能根据水解程度判断对应的酸性强弱。
知识点
28.(Ⅰ)环境问题已成为社会关注的焦点。某农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
(1)方法一:将CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,则溶液中c(PO43-)=_______(已知Ksp[Ca3(PO4)2]=2×10-33)
(2)方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应式为Mg2+(aq) + NH4+(aq) + PO43-(aq)
(Ⅱ)在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) 
(1)上述反应中Q_________0(选填“>”或“<”)
(2)温度为850℃时,可逆反应CO(g)+H2O(g) 
①计算:3 min时(CO的浓度) C1 = _______mol/L,H2O (g)的转化率= ________.
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是_______,表中5min~6min之间数值发生变化,可能的原因是____________。
a . 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
正确答案
(Ⅰ)(1)Ksp[Ca3(PO4)2]=
(Ⅱ)(1)> (2) ①0.08 40% ②d a
解析
解析已在路上飞奔,马上就到!
知识点
13.分别取等物质的量浓度的NaOH溶液各100 mL,再通入一定量的CO2随后分别各取20mL溶液,向其中逐滴滴入0.2 mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况): 下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.常温下,下列对有关溶液的判断不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.实验探究题
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: Fe3+ > Br2, 因此上述实验现象不是发生化学反应所致, 则溶液呈黄色是含( )(填化学式)所致。
②乙同学认为氧化性: Br2 > Fe3+, 因此上述实验现象是发生化学反应所致, 则溶液呈黄色是含( )(填化学式)所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 ( ) 。
②在100mL FeBr2溶液中通入22.4L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 ( )mol/L。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O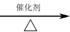
已知:CO+2H2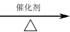
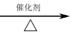
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
正确答案
(1)89.6 (2)2.4 mol/L≥c≥1.2 mol/L(3)
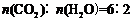
设CO2转化率为α,CO转化率为β300β+100α=350 600β+300α=900-120 α=80%或设CO2转化率为α 900−350×2−100α=120 α=80/100=80%
知识点
6.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
正确答案
解析
A、已知酸性:CH3COOH>H2CO3>Al(OH)3,所以水解程度:偏铝酸钠>碳酸氢钠>醋酸钠,当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是①>②>③,故A不选;
B、结合物料守恒分析可知,溶液中钠离子和碳原子的物质的量之比为(0.5×2+a):(0.5+a),c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故B不正确;
C、10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,发生反应,生成0.001mol醋酸钠、剩余0.001mol氢氧化钠,醋酸钠和氢氧化钠的物质的量相同,
物料守恒得:c(Na+)= 2[c(CH3COO-)+c(CH3COOH)] ,
电荷守恒得:c(Na+)+c(H+)= c(CH3COO-) +c(OH-) , 二式联立,化简得:
c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)D、25℃某浓度的NaCN溶液的pH=d,该溶液中c(OH-)=10d-14mol/L,即水电离出的c(OH-)=10d-14mol/L,故D不正确;
考查方向
本题主要考查溶液中三大守恒关系:物料守恒、电荷守恒、质子守恒,溶液中离子浓度大小的比较。
解题思路
A项:酸性:CH3COOH>H2CO3>Al(OH)3,根据越弱越水解,水解度:NaAlO2>NaHCO3 >CH3COONa, c(Na+):①>②>③;B项根据物料守恒分析;C项正确;D项NaCN溶液的OH-全部来自于水的电离。
易错点
弱酸、弱碱的电离以及盐类的水解都是很弱的。越弱越水解是盐类的水解的重要规律之一。
知识点
22.将5.6gFe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为
正确答案
解析
因最后气体为NO,设其物质的量为x,
铁与浓硝酸反应时,铁失去电子,氮元素得到电子,且A为二氧化氮,
在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,是亚铁失去电子,氮元素得电子,且B为氧气,
A、B气体混合通入足量水生成硝酸和NO,
根据守恒思想,计算时抓住反应的始终态即可,反应物可看作Fe、HNO3和水,最终生成物是Fe2O3和剩余气体,A和B混合气体通入水中,剩余气体是NO或O2,根据电子得失守恒可定性判断出剩余气体不可能是O2,则剩余气体只能是NO,设其物质的量为x,则整个过程中由得失电子守恒可知,

考查方向
解题思路
明确发生的化学反应,注意元素化合价的变化,明确最后的物质,利用电子守恒来快速计算是解答的关键,从而可避免中间过程的繁杂计算.
易错点
利用电子守恒计算
知识点
7.下列实验能达到预期目的是( )
正确答案
解析
A.NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱。错误。B. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+而使溶液显碱性,因此向该盐的水溶液中滴加酚酞变为红色。若向含有酚酞的Na2CO3溶液中加入少量BaC12固体,会发生反应:CO32-+Ba2+=BaCO3↓,使CO32-的水解平衡逆向移动。水解程度减小,所以溶液的减小减弱,溶液红色变浅。正确。C. 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀。但是该沉淀存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),当再滴加2滴0.1 mol/LFeCl3溶液时由于,c(Fe3+)·c(OH-)≥Ksp [Fe(OH)3],所以又生成红褐色沉淀。由于Mg(OH)2 和Fe(OH)3的构型不同,因此这只能证明沉淀在溶液中存在沉淀溶解平衡,而不能证明其Ksp的大小。错误。D.证明元素的非金属性的强弱,要看其最高价氧化物对应的水化物的酸性强弱。Na2SO3不是S的最高价含氧酸的钠盐。错误。
考查方向
本题考查元实验设计,考查学生解决问题的能力
解题思路
对与电解质在溶液中需要考虑是否溶解,溶解是否电离,是否再次电离,电离是否完全,电离出了阴阳离子是否水解,水解是否分步,溶液中存在的阴阳离子是否符合离子反应条件。这是解决此类问题的一般思路。
易错点
实验设计的科学性、合理性、严谨性容易导致学生判断
知识点
4. 下列溶液中微粒浓度关系一定正确的是 ( )
正确答案
解析
A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+),A错误;
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-),B错误;
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S),C错误;
D.氢氧化钠与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+)+c(Na+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+)+c(Na+),D正确。
故选D。
考查方向
解题思路
A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+);
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-);
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S);
D.氢氧化钠与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+)+c(Na+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+)+c(Na+)。
易错点
本题考查离子浓度大小比较,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握盐类水解的特点,结合电荷守恒、物料守恒解答该题,难度中等。
知识点
扫码查看完整答案与解析