- 化学平衡常数的含义
- 共77题
高炉炼铁过程中发生的反应:

正确答案
解析
略
知识点
(18分)请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
正确答案
解析
略。
知识点
大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaⅠ溶液中进行模拟研究。
(1)O3将Ⅰ-氧化成Ⅰ2的过程由3步反应组成:
①Ⅰ-(aq)+ O3(g)=ⅠO-(aq)+O2(g)△H1
②ⅠO-(aq)+H+(aq) 
总反应的化学方程式为______,其反应△H=______
(2)在溶液中存在化学平衡:
(3) 为探究Fe2+对氧化Ⅰ-反应的影响(反应体如图13),某研究小组测定两组实验中Ⅰ3-浓度和体系pH,结果见图14和下表。
① Ⅰ组实验中,导致反应后pH升高的原因是_______.
② 图13中的A为_____由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是_______.
③第2组实验进行18s后,Ⅰ3-下降。导致下降的直接原因有双选______.
(4)据图14,计算3-13s内第2组实验中生成l3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1)
(2)
(3)①H+被消耗,其浓度降低;②


(4)
解析
本题考查了盖斯定律、化学平衡常数,化学平衡的移动以及化学反应速率的计算等知识。(1)根据题给信息,总反应为O3氧化I-生成I2,将所给的三个反应:①+②+③可得



③c(Fe3+)增加,
v(I3-)=
知识点
请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)═CH3OH(g)△H1=﹣116KJ•mol﹣1
又知:CO(g)+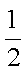
H2(g)+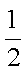
H2(g)+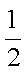
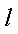
则甲醇的燃烧热为_______。
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol,该反应的速率v(H2)为_______;下列措施中有利于增大该反应的反应速率且提高转化率的是_______。
A. 随时将CH3OH与反应混合物分离
B. 降低反应温度
C. 使用高效催化剂
D. 增大体系压强
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示。
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA_______tc(填“大于”、“小于’’或“等于“)。
②若A点时容器的体积为10L,该温度下B点的平衡常数K=_______。
(4)Na2SO3的水溶液呈_______(填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示):_______;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程_______(已知:Ksp(CaSO3)=1.4×10﹣7,Ksp(CaCO3)=2.8×10﹣9)。
正确答案
(1)﹣739kJ•mol﹣1
(2)0.4mol/(L•min)d
(3)①大于 ②1
(4)碱 SO32﹣+H2O⇌HSO3﹣+OH﹣ 可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32﹣)>50c(CO32﹣)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0。1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32﹣)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3⇌Ca2++CO32﹣,向着溶解的方向移动,导致CaCO3溶解。
解析
略。
知识点
28.乙苯催化脱氢制苯乙烯反应:
(1)已知:
计算上述反应的△H=_______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
正确答案
(1)124 ; (2) 

(3) ① 正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果
②600℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大
(4) ①②③④
性下降。高温还可能使催化剂失活,且能耗大。(4) ①乙苯催化脱氢制苯乙烯反应为可逆反应,CO2与H2
反应,可使生成物浓度减小,化学平衡右移;②不用高温水蒸气,必然降低能耗;③由于发生反应
CO2+C=2CO,可减少积炭;④CO2得到有效利用,可减少CO2排放并作为资源得到利用。故选择①②③④。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析













