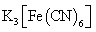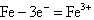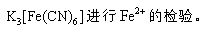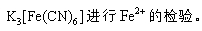- 真题试卷
- 模拟试卷
- 预测试卷
6.中国传统文化对人类文明贡献巨大,古化文献中充分记载了古代化学研究成果.下列关于KNO3的古代文献,对其说明不合理的是
正确答案
解析
A、KNO3 加热后才分解,不能自燃;
B、鉴别KNO3 和Na2SO4中钾元素和钠元素的焰色反应;
C、提纯的方法是利用溶解后,高温浓缩降温蒸发结晶;
D、火药发生化学反应的时候,KNO3 中氮元素的化合价降低,体现氧化性。
考查方向
本题主要考查了元素及其化合物的化学性质、氧化剂、焰色反应。
解题思路
A、KNO3不能自燃;
B、KNO3 和Na2SO4的焰色反应颜色不同K紫色Na黄色;
C、利用溶解后高温浓缩降温蒸发结晶;
D、KNO3 氧化剂中氮元素的化合价降低。
易错点
焰色反应、氧化性的判断。
知识点
9.某厂用Na 除掉苯中的水分。某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na 。下列处理方法更合理、更安全的是
正确答案
解析
A、打开反应釜,将Na 暴露在空气中与氧气反应,钠暴露在空气中会与空气中的水和氧气反应,但钠与水反应放出大量热;
B、向反应釜通入Cl2 ,钠在氯气中燃烧会放出大量的热;
C、向反应釜加大量H2 O,钠与水反应放出大量的热;
D、向反应釜滴加C2 H5 OH,并设置放气管,排出氢气和热量,反应速度相对缓慢,更安全、更合理。
考查方向
本题主要考查了实验室安全及钠的相关化学知识。
解题思路
A、钠暴露在空气中会与空气中的水和氧气反应;
B、钠在氯气中燃烧;
C、钠与水反应属于放热反应;
D、C2 H5 OH中C-O-H中0-H可断键。
易错点
向反应釜加大量H2 O,通过化学反应“除掉”金属钠,钠与水反应属于放热反应;C2 H5 OH中C-O-H中0-H可断键。
知识点
10.《常用危险化学用品贮存通则》规定:“遇火、遇热、遇潮能引起燃烧、爆炸或发生化学反应,产生有毒气体的化学危险品不得在露天或在潮湿、积水的建筑物中贮存”。下列解释事实的方程式中,不合理的是
正确答案
解析
A、氮气和氧气反应的条件是光照或高温;
B、硝酸铵在加热时生成氮气、氧气和水蒸气;
C、干燥的氯化铝遇水发生水解,当生成氯化氢气体时氯化铝的水解完全;
D、电石的主要成分碳化钙与水反应生成氢气同时放出大量热,会发生爆炸。
考查方向
本题主要考查了元素及其化合物的化学性质。
解题思路
A、条件是光照或高温;
B、硝酸铵在加热时生成氮气、氧气和水蒸气;
C、干燥的氯化铝遇水发生水解;
D、电石的主要成分碳化钙。
易错点
氮气和氧气反应的条件是光照或高温、干燥的氯化铝遇水发生水解。
知识点
12.某同学做如下实验:
下列说法正确的是
正确答案
解析
对比两个盐桥的双液装置,图1 中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等。图2 中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极发生的反应是 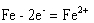
考查方向
本题主要考查了原电池
解题思路
对比两个盐桥的双液装置,图1 中发生的是普通的化学腐蚀,且腐蚀速率相等。图2 中发生的是电化学腐蚀可以用
易错点
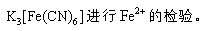
知识点
8.下列检测方法不合理的是
正确答案
C
解析
A、制备氢氧化铁胶体的操作和胶体的鉴别方法;
B、利用的是硫酸铜在水溶液中呈现蓝色;
C、滴加BaCl2溶液后BaCl2分别和AgNO3 和Al2(SO4)3反应生成氯化银和硫酸钡沉淀;
D、经四氯化碳萃取后的氯气不能使干燥的红布条褪色。
考查方向
解题思路
A、胶体的鉴别方法:丁达尔现象;
B、利用生成物离子的颜色差异,硫酸铜在水溶液中呈现蓝色;
C、BaCl2分别和AgNO3 和Al2(SO4)3反应生成氯化银和硫酸钡沉淀;
D、氯气和水反应生成的次氯酸具有漂白性。
易错点
氯气和水反应生成的次氯酸具有漂白性。
知识点
11.下列“试剂”和“试管中的物质”不能完成“实验目的”的是
正确答案
B
解析
A、饱和溴水与苯进行萃取、与苯酚生成三溴苯酚沉淀,验证了羟基对苯环活性的影响;
B、酸性高锰酸钾与甲苯反应生成苯甲酸,溶液褪色,验证苯环对甲基活性的影响;
C、己烯能使溴的四氯化碳溶液褪色,而苯不能,证明苯中无碳碳双键;
D、碳酸能使石蕊变色,苯酚不能使石蕊变色,证明碳酸的酸性强于苯酚的酸性。
考查方向
解题思路
A、验证了羟基对苯环活性的影响;
B、验证苯环对甲基活性的影响;
C、证明苯中无碳碳双键;
D、证明碳酸的酸性强于苯酚的酸性。
易错点
己烯能使溴的四氯化碳溶液褪色,而苯不能,证明苯中无碳碳双键;酸性高锰酸钾与甲苯反应生成苯甲酸,溶液褪色。
知识点
备有机物A 为缓释阿司匹林的主要成分。用于内燃机润滑油的有机物Y 和用于制
水凝胶的聚合物P 的合成路线如下。
已知:
13.D 的分子式为C7H6O3,D 中所含的官能团是 。
14.D→Y的化学方程式是 。
15. 反应Ⅰ的另一种产物是M ,其相对分子质量是60,B 、M 均能与NaHCO3反应产生 CO2。
①M 是 。
②B→D的化学方程式是 。
16.下列说法正确的是 。
a. B 、C 、D 中均含有酯基
b.乙二醇可通过
c.C 能与饱和溴水反应产生白色沉淀
17.红外光谱测定结果显示,E 中不含羟基。
①X→E的反应类型是 。
② E 的结构简式是 。
18.若X的聚合度n=1,有机物A 只存在一种官能团,A 的结构简式是 。
19.聚合物P 的结构简式是 。
正确答案
羟基、羧基
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
正确答案
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。
2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。
3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
正确答案
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。
2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。
3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
正确答案
b
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
本题主要考查了有机物的结构、性质的推断,同分异构体的判断。
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。
2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。
3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
正确答案
①酯化反应(答“取代反应”也可)
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
本题主要考查了有机物的结构、性质的推断,同分异构体的判断。
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。
2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。
3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
正确答案
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。
2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。
3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
正确答案
解析
“缓释阿司匹林”提示了乙酰水杨酸和水杨酸结构出现的可能。由D→Y 的反应可以看出是合成酚醛树脂的过程。结合D 的分子式C7H6O3,可以推知D 是邻羟基苯甲酸。由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。结合M 的相对分子质量可以得出M 为乙酸,B 为乙酰水杨酸。注意到由A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。若E 中不含羟基,可知E 必然是X 两侧酯化产物。最后E 发生共聚,得到聚合物P。
考查方向
本题主要考查了有机物的结构、性质的推断,同分异构体的判断。
解题思路
1.由D→Y 的反应可以看出是合成酚醛树脂的过程。
2.由于反应I 另一产物M 能与NaHCO3 反应产生CO2,可知M 含羧基。
3.A 两次酸性水解,先后得到C 和X,可知A 是X 两侧与乙酰水杨酸成酯产物,C 是单侧与乙酰水杨酸成酯产物。
易错点
D→Y 的反应过程,推导聚合物P 的结构简式。
氢能是理想的清洁能源,资源丰富。以太阳能为热源分解 Fe3O4 ,经由热化学铁氧化合物循环分解水制H2 的过程如下:
20.过程Ⅰ:
①将O2分离出去,目的是提高Fe3O4的 。
②平衡常数K 随温度变化的关系是 。
③在压强 p1下, Fe3O4的平衡转化率随温度变化的

21.过程Ⅱ的化学方程式是 。
22.其他条件不变时,过程Ⅱ在不同温度下, H2 O的转化率随时间的变化
23.科研人员研制出透氧膜(OTM) ,它允许电子、O 2-同时透过,可实现水连续分解制H2。工作时,CO、H 2O分别在透氧膜的两侧反应。工作原理示意图如下:
H2 O 在 侧反应(填“ a ”或“ b ”),在该侧H2 O 释放出 H2 的反应式是 。
正确答案
①转化率。
②随着温度升高,平衡常数K 变大。
③
解析
①过程I 的反应中,分理出O2 可以使反应正向移动,提高Fe3O4 的转化率。
②本反应为吸热反应,温度升高平衡正向移动。
③压强增大,平衡向气体系数减小的方向移动,转化率降低。
考查方向
本题主要考查了化学平衡的移动、电化学。
解题思路
①O2 可以使反应正向移动。
②本反应为吸热反应。
③压强增大,平衡向气体系数减小的方向移动。
易错点
根据原子守恒,完成配平;外界条件对平衡移动的影响。
正确答案
解析
反应物为FeO 和H2O,生成物为Fe3O4 和H2。根据原子守恒,完成配平。
考查方向
解题思路
根据原子守恒,完成配平。
易错点
根据原子守恒,完成配平;外界条件对平衡移动的影响。
正确答案
T 1>T2>T3;初始压强相同,浓度相同,图像斜率T 1>T2>T3,温度越高,反应速率越大,则说明T 1>T2>T3。
解析
可以从图像斜率看出速率大小。温度与速率呈现正相关。得到T 1>T2>T3 。
考查方向
本题主要考查了化学平衡的移动、电化学。
解题思路
温度与速率呈现正相关。
易错点
根据原子守恒,完成配平;外界条件对平衡移动的影响。
正确答案
a;
解析
本实验利用水制取氢气,H2O 得电子生成H2 和O2-,O2-通过OTM 进入b 侧,所以H2O在a 侧,反应方程为
考查方向
本题主要考查了化学平衡的移动、电化学。
解题思路
H2O 得电子生成H2 和O2-,O2-通过OTM 进入b 侧。
易错点
根据原子守恒,完成配平;外界条件对平衡移动的影响。
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大。
24.红酒中添加一定量的SO2 可以防止酒液氧化。这应用了SO2 的 性。
25.某水体中硫元素主要以S2 O32- 形式存在。在酸性条件下,该离子会导致水体中亚硫酸的浓度增大,原因是 。
26.实验室采用滴定法测定某水样中亚硫酸盐含量:
①滴定时,KIO3 和KI 作用析出I2 ,完成并配平下列离子方程式:
②反应①所得I2 的作用是 。
③滴定终点时,100mL的水样共消耗xmL标准溶液。若消耗1mL标准溶液相当于SO 32-的质量1g ,则该水样中SO 32- 的含量为 mg / L 。
27.微生物燃烧电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示:
① HS- 在硫氧化菌作用下转化为SO 42-- 的反应式是 。
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是 。
正确答案
还原性;
解析
SO2 抗氧化,体现还原性。
考查方向
解题思路
SO2还原性。
易错点
氧化还原的配平、中和滴定的计算。
正确答案
在酸性条件下,溶液中的

解析
没有其他的良好氧化剂存在于体系中,只能

考查方向
解题思路

易错点
氧化还原的配平、中和滴定的计算。
正确答案
①
②氧化
③104 x
解析
①根据质量守恒和电荷守恒进行配平。
②滴定实验需要有明显现象的指示剂,而此时反应生成的和淀粉的显色反应明显,故不需要其他指示剂,减少误差。另外,利用I2 的氧化性,滴定水样。
③本题考查元素化合物相关计算问题。
考查方向
解题思路
①根据质量守恒和电荷守恒进行配平。
②滴定实验反应生成的和淀粉的显色反应明显,利用I2 的氧化性,滴定水样。
③本题考查元素化合物相关计算问题。
易错点
氧化还原的配平、中和滴定的计算。
正确答案

解析
①酸性环境中反应物为HS- 产物为
②从质量守恒角度来说,
考查方向
本题主要考查了氧化还原的配平、中和滴定。
解题思路
①酸性环境中反应物为HS- 产物为
②从质量守恒角度来说,
易错点
氧化还原的配平、中和滴定的计算。
某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
实验操作和现象:
28.现象i 中的白雾是______________,形成白雾的原因是_____________。
29.分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红。
通过该实验说明现象ii 中黄色气体含有____________________。
30.除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是____________。实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___________。
31.为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在。
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C 。
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+ .
现象如下:
方案 1 :B 中溶液变为蓝色
方案 2 :B 中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是 。
②方案2 中检验 Fe 2+的原因是 。
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是 。
32.将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是 。
正确答案
HCl 小液滴FeCl3·6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴
解析
考查盐类水解的应用,注意说明盐酸小液滴中HCl 和H2O 的来源即可。
考查方向
本题主要考查了氯气的实验室制法及其综合运用、盐类水解的应用、陌生方程式的书写。
解题思路
说明盐酸小液滴中HCl 和H2O 。
易错点
Br-不会被Fe3+氧化为Br2、陌生方程式的书写。
正确答案
FeCl3
解析
Fe3+可以使KSCN 溶液变红,注意书写的是黄色气体,写FeCl3,不要写Fe3+。
考查方向
本题主要考查了氯气的实验室制法及其综合运用、盐类水解的应用、陌生方程式的书写。
解题思路
Fe3+可以使KSCN 溶液变红。
易错点
Br-不会被Fe3+氧化为Br2、陌生方程式的书写。
正确答案
①2Fe3++2I-=2Fe2++I2
②另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置。
观察一段时间后溶液是否变蓝。
解析
①检验出来的气体中含有FeCl3,书写Fe3+和I-的方程式即可。
②直接在装置上进行修改,需要除去Cl2 和Fe3+的干扰才能检验酸性情况下的O2 影响,无法进行操作。所以最好另取溶液对酸性情况下氧气的影响进行检验。因为原题中存在HCl 气体,所以酸化最好选用盐酸。
考查方向
本题主要考查了氯气的实验室制法及其综合运用、盐类水解的应用、陌生方程式的书写。
解题思路
①检验出来的气体中含有FeCl3。
②直需要除去Cl2 和Fe3+的干扰才能检验酸性情况下的O2 影响,
易错点
Br-不会被Fe3+氧化为Br2、陌生方程式的书写。
正确答案
①饱和NaCl 溶液
②排除Fe3+将Br-氧化成Br2 的可能性。
③Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2。
解析
①方案1 思路:除去Cl2 中的FeCl3 和O2(H+),若仍能观察到B 中溶液仍变为蓝色,则证明原气体中确实存在Cl2。所以C 中盛放的试剂是用来除去FeCl3 和O2(H+)而不除Cl2 的。使用饱和NaCl 溶液,可以让FeCl3 溶解,并且除去O2 影响过程中提供酸性的HCl 气体,从而排除两个其他影响因素。
②方案2 思路:若B 中观察到浅橙红色,则证明有物质能够将Br-氧化成Br2,若未检查到Fe2+,则证明是Cl2 氧化的Br-,而不是Fe3+。另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题。
③NaBr 比KI-淀粉溶液好的原因,在于Fe3+能氧化I-对检验Cl2 产生干扰,而Fe3+不会氧化Br-,不会产生干扰。另外,最好请熟记氧化性Cl2>Br2>Fe3+>I2,在大量离子反应和实验探究题目中会有涉及。
考查方向
本题主要考查了氯气的实验室制法及其综合运用、盐类水解的应用、陌生方程式的书写。
解题思路
①方案1 思路:除去Cl2 中的FeCl3 和O2(H+),若仍能观察到B 中溶液仍变为蓝色,则证明原气体中确实存在Cl2。
②方案2 思路:若B 中观察到浅橙红色,则证明有物质能够将Br-氧化成Br2,若未检查到Fe2+,则证明是Cl2 氧化的Br-,而不是Fe3+。
③Fe3+能氧化I-对检验Cl2 产生干扰
易错点
Br-不会被Fe3+氧化为Br2、陌生方程式的书写。
正确答案
3MnO2+4FeCl3·6H2O==(带加热符号)2Fe2O3+3MnCl2+3Cl2↑+24H2O
解析
陌生方程式的书写,注意各物质的配平系数。3MnO2+4FeCl3·6H2O==(带加热符号)2Fe2O3+3MnCl2+3Cl2↑+24H2O。
考查方向
本题主要考查了氯气的实验室制法及其综合运用、盐类水解的应用、陌生方程式的书写。
解题思路
各物质的配平系数。
易错点
Br-不会被Fe3+氧化为Br2、陌生方程式的书写。