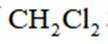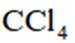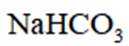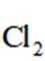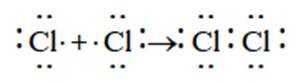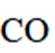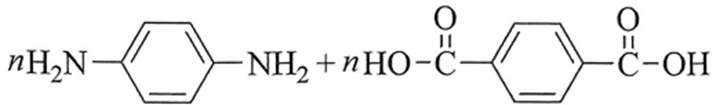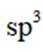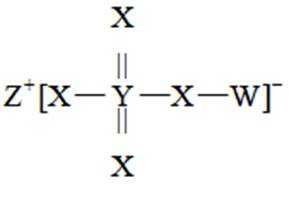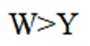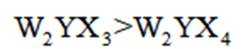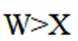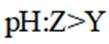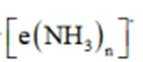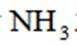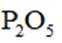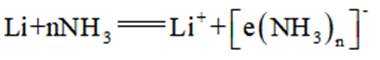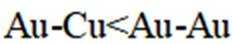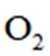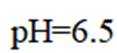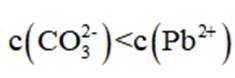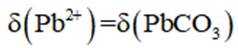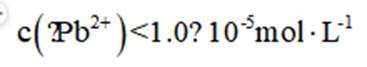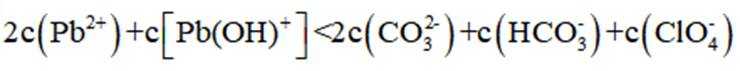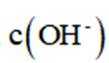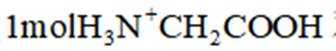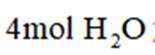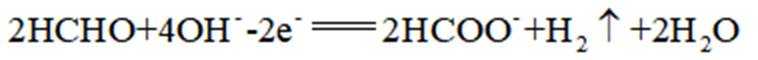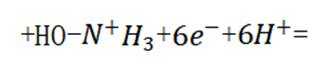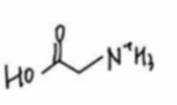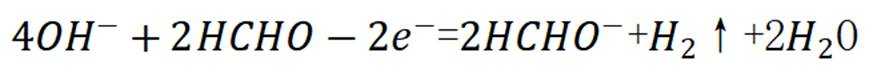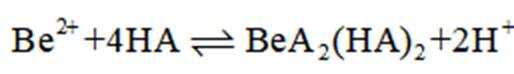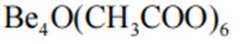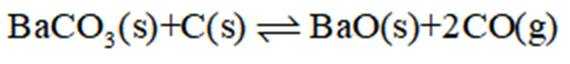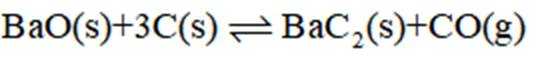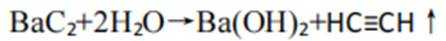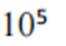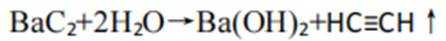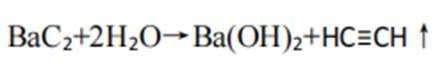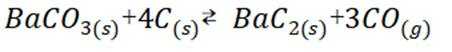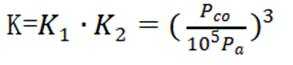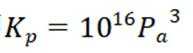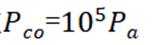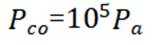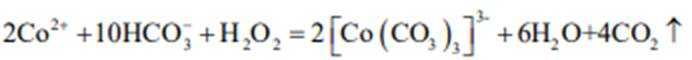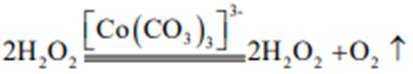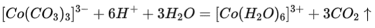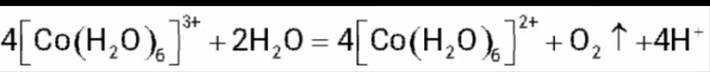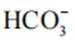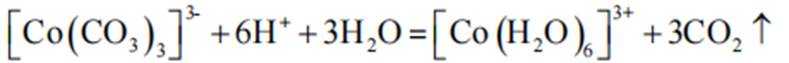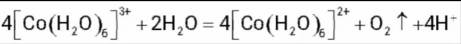- 真题试卷
- 模拟试卷
- 预测试卷
劳动人民的发明创造是中华优秀传统文化的组成部分。下列化学原理描述错误的是( )
正确答案
解析
本题为中华传统文化与化学反应相结合,考查较为基础,偏重概念性知识
A、松木焖烧缺少氧气,不完全燃烧会生成碳单质,生活中常见的炭黑也是由此产生的,碳单质可用来制墨,正确
B、陶瓷的主要成分是二氧化硅和硅酸盐,粘土富含硅酸盐矿物,硅酸盐矿物高温分解产生二氧化硅,有新化学键形成,正确
C、草木灰的主要成分是碳酸钾,水溶液呈碱性。纤维素只有在酸性催化剂(如浓硫酸)或酶的催化作用下才会水解,碱性条件不水解,错误
D、反应方程式为
故选C
2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效的防锈措施,下列防锈措施中不形成表面钝化膜的是( )
正确答案
解析
本题结合时事,考查了化学工艺的工业用途
A、发蓝处理是一种热处理工艺,用于钢材钢件,将其中所含的铁氧化成磁性氧化铁(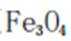
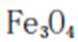
B、阳极氧化又称阳极保护,被保护金属与电源正极相连,表面被氧化形成一层氧化膜,正确
C、表面渗镀是一种表面处理的方法,在高温下将气态、固态或熔化状态的欲渗镀的物质(金属或非金属元素)通过扩散作用从被渗镀的金属的表面渗入内部,在表层形成合金镀层,正确
D、喷涂油漆只是在金属表面喷涂其他物质来隔绝氧气,没有使金属自身发生变化、形成钝化膜,错误
故选D
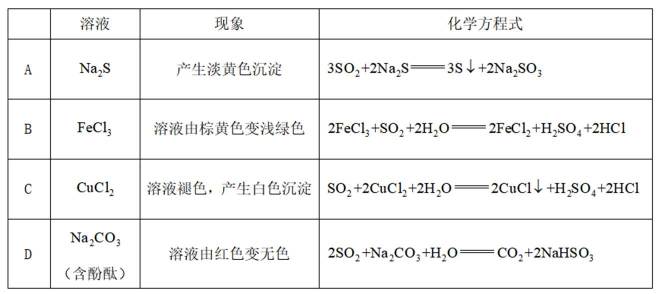
关于物质的分离、提纯,下列说法错误的是( )
正确答案
解析
本题考查了物质分离提纯的方法,涉及物质状态、物理性质,侧重基础知识
A、二者分别是甲烷的二氯代物和四氯代物,氯原子数越多,沸点越低。常温下前者为气态,后者为油状液态,沸点相差大,可以蒸馏分离,正确
B、二者都具有水溶性,难以通过过滤分离,且过滤方法通常用来分离固体和液体,错误
C、萃取使青蒿中的青蒿素溶于有机溶液,通过柱色谱法,使青蒿素吸附在色谱柱上,再用极性溶剂将其洗脱,得到纯净的青蒿素,正确
D、氯化钠和苯甲酸溶解度相差较大,可通过重结晶将低温下溶解度较小的苯甲酸分离出来,正确
故选B
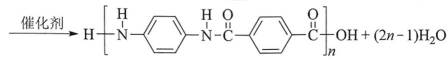
化学用语可以表达化学过程,下列化学用语表达错误的是( )
正确答案
解析
本题考查了化学用语的使用,兼顾方程式书写的考查
A、Cl在第七主族,书写电子式时最外层7个电子围绕其呈2、2、2、1分布,在形成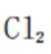
B、亚铜氨中铜元素为+1价,而选项所给离子中铜元素为+2价,错误
C、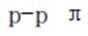
D、两种单体在缩聚时,首尾的一对单体只脱去1分子水,其余(n-1)对单体脱去2分子水,故一共脱水(2n-1),正确
故选B
基本概念和理论是化学思维的基石。下列叙述错误的是( )
正确答案
解析
本题考查了元素、原子和分子的相关理论
A、VSEPR模型包括孤电子对,而分子的空间结构则不考虑孤电子对占据的位置,当分子不含孤电子对时二者相同,分子含有孤电子对时二者不同。如:水分子的VSEPR模型为四面体型,而其空间结构为V型,两种结构不同,错误
B、元素性质随着原子序数递增而呈周期性变化的规律,叫元素周期律,这种周期性变化是原子核外电子排布周期性变化的结果,正确
C、泡利不相容原理:一个原子轨道最多只能容纳两个电子,且二者自旋状态相反,正确
D、1个s轨道和3个p轨道混杂,形成4个能量相同、方向不同的轨道,称为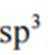
故选A
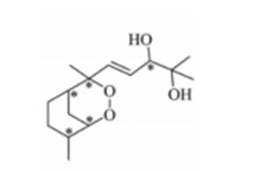
鹰爪甲素(如图)可从治疗疟疾的有效药物鹰爪根中分离得到。下列说法错误的是( )
正确答案
解析
本题考查了陌生有机化合物的结构和性质
A、手性碳是指连接了四个不同基团的碳原子,如图所示,鹰爪甲素中有5个手性碳,正确
B、该化合物含有过氧化键,不稳定,在高温条件下易分解。
C、鹰爪甲素的分子式为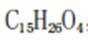
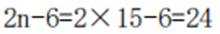
D、分子中含有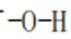
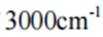
故选B
过量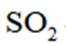
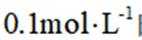
正确答案
解析
本题考查了化学方程式书写,主要是二氧化硫及其有关的涉及量的反应
A、题干中“过量”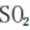

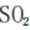
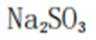
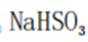
B、过量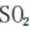

C、过量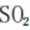
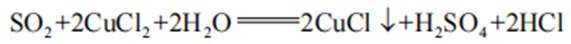
D、由于碳酸根的水解,碳酸钠溶液呈碱性,遇酚酞变红。过量

故选A
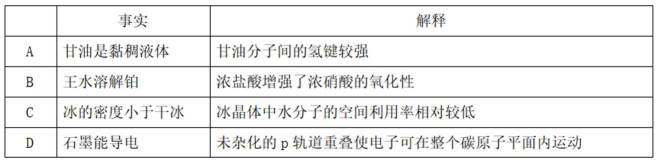
结构决定性质,性质决定用途。下列事实解释错误的是( )
正确答案
解析
本题考查了化学物质结构与性质的对应关系,涉及化学键、化学方程式、晶体结构、原子轨道等内容
A、甘油的结构为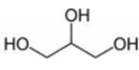
B、王水溶解铂是由于浓盐酸提供的氯离子,结合了硝酸氧化Pt产生的高价态铂离子,形成稳定的配合物,使硝酸参与的氧化反应不断正移,促进了Pt的溶解,这个过程中浓盐酸未起到氧化性的作用,错误
C、由于水分子间氢键的方向性,冰晶体中水分子有序排列为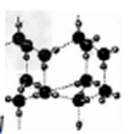
D、石墨属于混合型晶体,在石墨的二维结构平面内,第个碳原子以C-C键与相邻的3个碳原子结合,形成六元环层。碳原子有4个价电子,而每个碳原子仅用3个价电子通过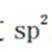
故选B
主族元素W、X、Y、Z原子序数依次增大,X、Y的价电子数相等,Z的价电子所在能层有16个轨道,4种元素形成的化合物如图。下列说法正确的是( )
正确答案
解析
本题考查了元素推断,及相应化合物的性质
主族元素W、X、Y、Z原子序数依次增大,X、Y的价电子数相等,Z的价电子所在能层有16个轨道。由化合物成键情况,Y成6根键,一定位于第六主族,且X、Y同族,Y原子序数更大,
所以Y是S,X是0。Z原子序数比S大,能形成+1价离子,位于第一主族,是K。阴离子为-1价,其中S为+6价,4个0一共呈-8价,可计算出W呈+1价,且原子序数小于0,只能是H。得到元素W、X、Y、Z分别为H、0、S、K。
A、在化合物HS中,H为+1价,S为-2价,所以S元素颠覆性更强,错误
B、两个化合物分别为亚硫酸和硫酸,硫酸为S的最高价氧化物对应的水化物,故酸性:亚硫酸<硫酸,错误
C、H、0基态原子未成对电子数分别为1、2,前者小于后者,错误
D、K的氧化物水溶液为KOH,呈碱性;Y的氧化物水溶液为亚硫酸或硫酸,呈酸性,故pH前者大于后者,正确
故选D
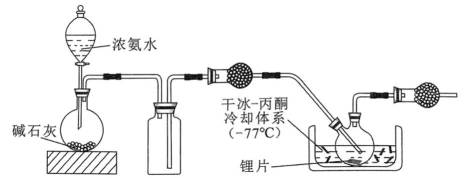
碱金属的液氨溶液含有的蓝色溶剂化电子是强还原剂。锂与液氨反应的装置如图(夹持装置略)下列说法错误的是( )
正确答案
解析
本题考查了实验装置设计及制备过程分析
A、碱石灰能够吸收浓氨水中的水分,且吸收后会放出大量热,能使浓氨水分解产生氨气,有利于氨气的产生和逸出,正确
B、锂片放置时间过长,表面会形成氧化锂,阻碍锂与液氨的接触。打磨能够去除表面的氧化膜,有利于反应物直接接触和反应的进行,正确
C、第一个干燥管是为了干燥氨气,氨气为碱性气体,五氧化二磷为酸性干燥剂,会吸收氨气使其无法参与后续反应。故第一个干燥管不能选用五氧化二磷,而末端是为了吸收尾气,可以选用五氧化二磷来吸收多余的氨气。错误
D、本实验要得到的产物为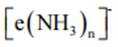
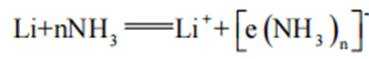
故选C
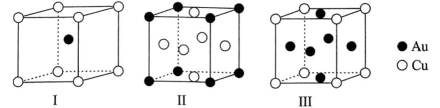
黄金按质量分数分级,纯金为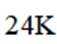
正确答案
解析
本题考查了晶胞结构及原子数目的计算方法
A、由题知24K金质量分数100%,则18K金质量分数为75%。在I中,Au原子有1个,Cu原子在立方体八个顶点,有8×1/8=1个,数目比1:1。Au质量分数为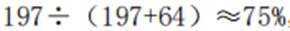
B、Ⅱ中Au在立方体八个顶点,Cu位于面心,类似于二氧化碳晶胞结构,类比得距离Au最近的Cu有12个,即Au的配位数为12,正确
C、设Ⅲ晶胞参数为a,即立方体边长为a,则最小核间距有:Au-Cu为面对角线的一半,即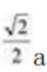
D、在I中,Au原子有1个,Cu原子在立方体八个顶点,有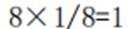
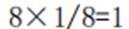
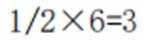
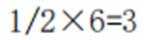
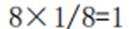
故选C
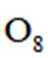
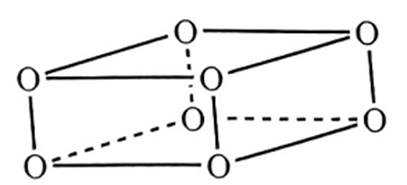
正确答案
解析
本题给出了特定反应,考查了同素异形体、物质结构和性质等知识点
A、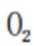
B、0g分子为平行六面体,由其结构知,0中存在两种氧氧键,分别是上下底面中的氧氧键和上下底面间的氧氧键,正确
C、超高压条件下,4分子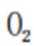
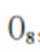
D、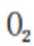
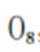
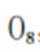
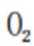
故选D
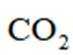
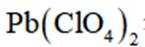
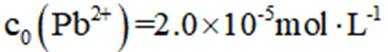
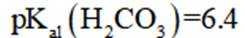
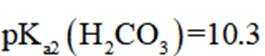
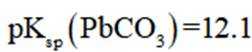
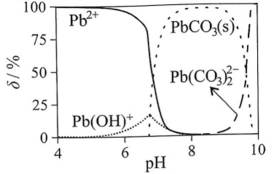
正确答案
解析
本题考查了溶液中的离子浓度分布及浓度比较,需要读出图中隐含的反应信息,会利用相应常数值进行计算
A、由图可知,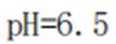
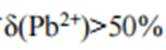
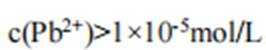
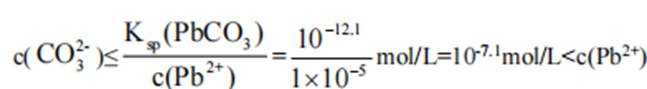
B、由图可知,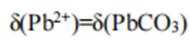
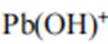
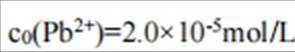
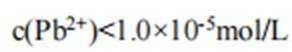
C、溶液中的电荷守恒为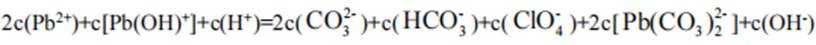
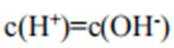
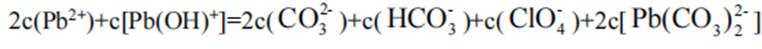
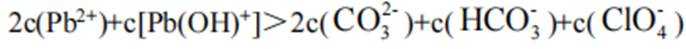
D、
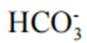
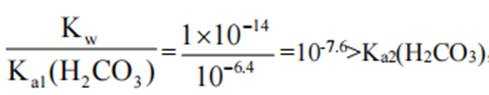

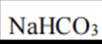
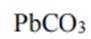
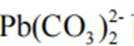
故选C
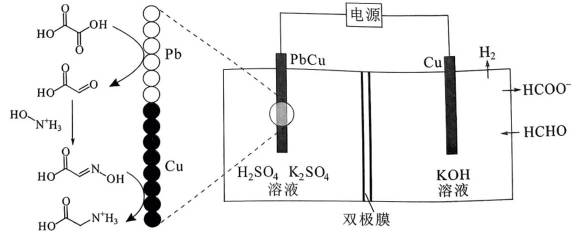
我国科学家设计了一种双位点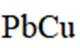
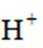
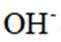
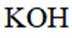
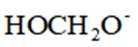
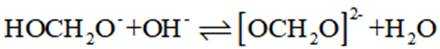
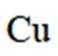
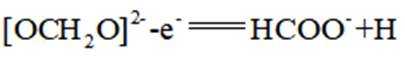
正确答案
解析
本题考查了电解池有关概念及陌生方程式书写
首先,有外接电源,所以本题是一个电解池。根据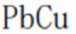
阴极区反应物为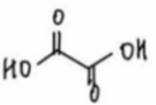
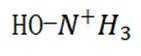
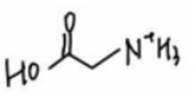
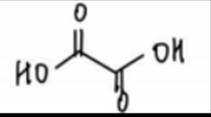
阳极区反应物为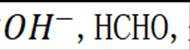
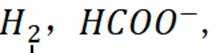
②
A、阴极区每发生
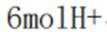
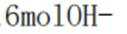
B、消耗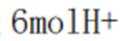
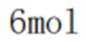
C、见分析,正确
D、在Pb电极上,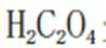
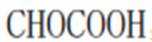

故选B
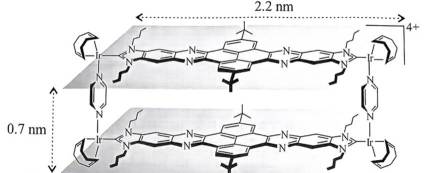
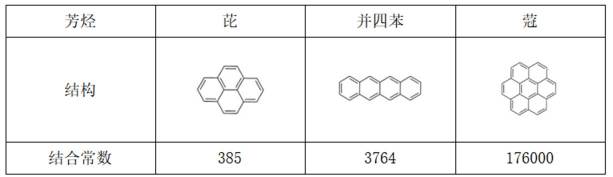
科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是( )
正确答案
解析
本题通过提供新型有机分子,考查了阅读和获取信息的能力
A、“分子客车”能装载多种稠环芳香烃,故芳烃与“分子客车”通过分子间作用力形成分子聚集体——超分子,正确
B、从长的方向观察,“分子客车”有与并四苯分子适配的结构,从高的方向观察则缺少合适结构,故平躺装载的稳定性大于直立装载的稳定性,错误
C、芘与“分子客车”中中间部分结构大小适配,故从分子大小适配看“分子客车”可装载2个芘,正确
D、读表,芘、并四苯、蔻中π电子数逐渐增多,与“分子客车”的结合常数逐渐增大,而结合常数越大越稳定,故芳烃π电子数越多越有利于和“分子客车”结合,正确
故选B
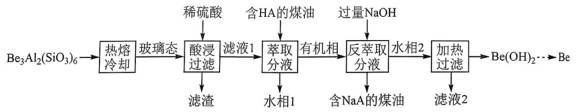
铍用于宇航器件的构筑。一种从其铝硅酸盐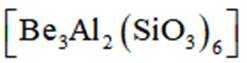
已知:
回答下列问题:
(1)基态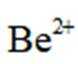
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是______________________。
(3)“萃取分液”的目的是分离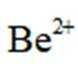
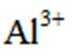
(4)写出反萃取生成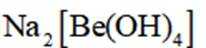
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是______________________。
(6)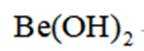
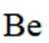
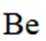
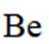
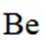
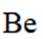
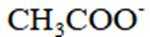
正确答案
(1)
(2)短时间快速冷却
(3)发生酸碱中和反应,无明显现象
(4)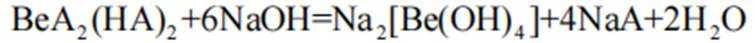
(5)增加熔融氯化铍的导电性
(6)
解析
(1)基态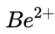
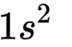
(2)熔融态物质冷却凝固时,缓慢冷却会形成晶体,快速冷却会形成非晶态,即玻璃态。所以要想从“热熔、冷却”中得到玻璃态,需要短时间快速冷却。
(3)“滤液1”中有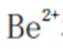
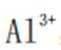
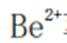
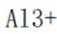
(4)方程式根据反应物和生成物进行配平。水相2中含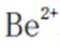
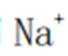
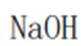
(5)氯化铍的共价性较强,电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用为增强熔融氯化铍的导电性。
(6)该配合物中有四个铍位于四面体的四个顶点上,四面体中心只有一个0,Be与Be之间总共有六个
用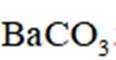
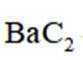
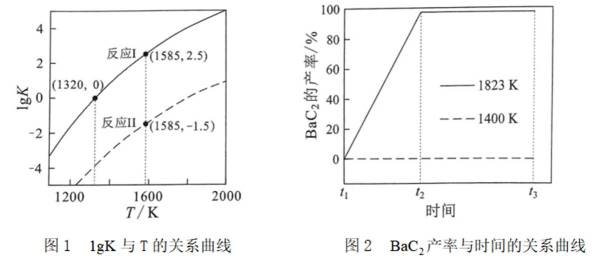
反应I:
反应II:
回答下列问题:
(1)写出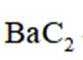
(2)已知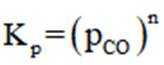
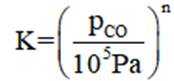
①反应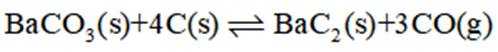
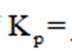
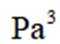
②保持1320K不变,假定恒容容器中只发生反应1,达到平衡时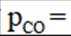
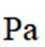

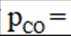
(3)恒压容器中,焦炭与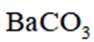
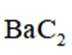
①初始温度为900K,缓慢加热至1400K时,实验表明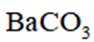
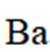
②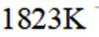
正确答案
(1)
(2)①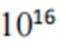
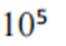
(3)①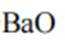
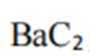
③容器中只有反应Ⅱ: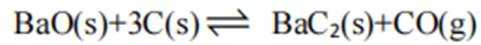
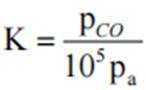
解析
(1)
Ba、Ca元素同主族,所以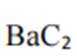
(2)①反应I+II有:
常数
且在1585K时,由图1,
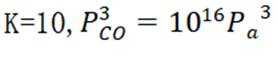
②由图1,1320K时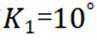
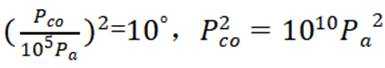
③K只受温度影响,故改变客积不会改变最终平衡时的状态,
(3)①由图2可知,1400K时,
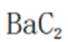
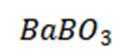
所以此时反应体系中含Ba物种为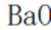
②图像显示,1823K时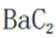
速率为一个定值,即速率保持不变;1400K时碳酸钡已全部消耗,此时反应体系的含钡物种只有氧化钡,即只有反应Ⅱ: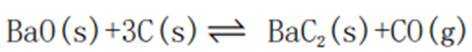
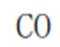
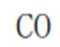
学习小组为探究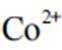
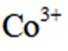
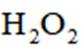
已知: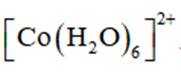
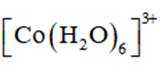
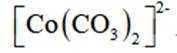
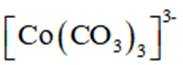
回答下列问题:
(1)配制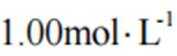
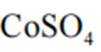
a.


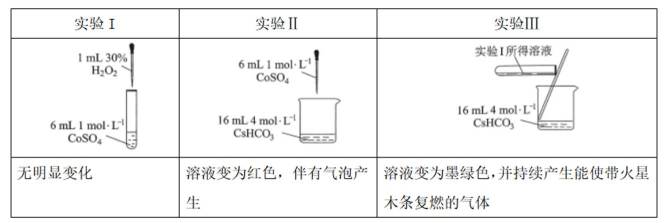
(2)实验I表明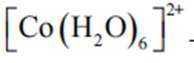
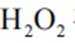
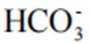
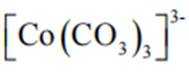
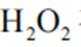
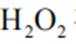
(3)实验I表明,反应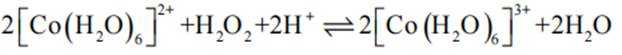
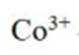
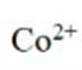
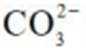
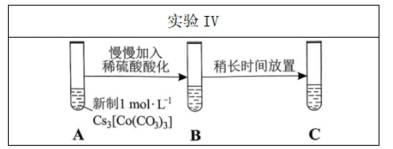
(4)实验V中,A到B溶液变为蓝色,并产生气体;B到C溶液变为粉红色,并产生气体。从A到C所产生的气体的分子式分别为___________、___________。
正确答案
(1)b、c;
(2)①不能
② 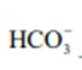
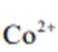
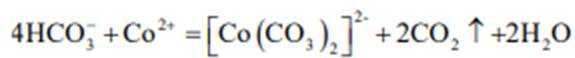
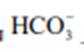
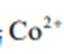
③
④
(3)实验Ⅲ的现象表明,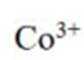
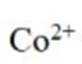
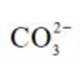
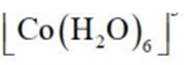
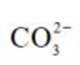
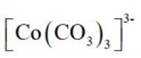
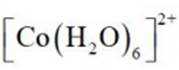
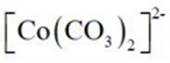
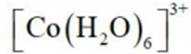
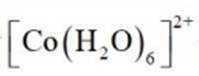
(4)①
②
解析
(1)容量瓶、胶头滴管是配制溶液时需要的仪器
(2)CoSO4溶液中存在大量的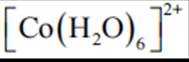
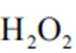
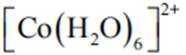
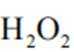
实验Ⅱ中发生反应的离子方程式为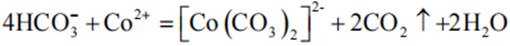
与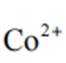
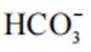

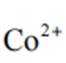
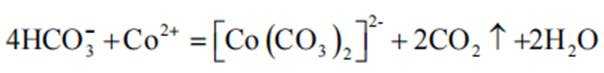
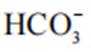
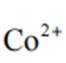
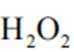
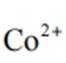
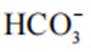
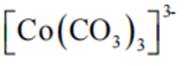
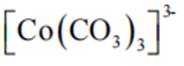
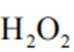
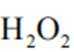
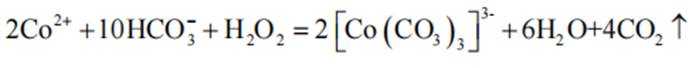
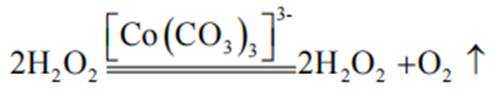
(4)①A到B发生反应:
②B到C发生反应:
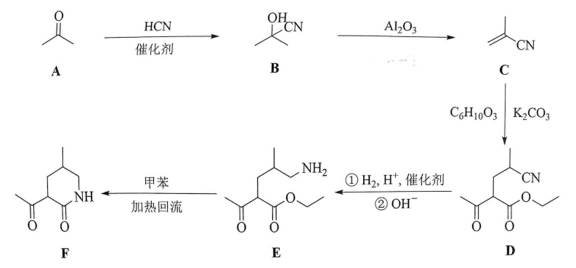
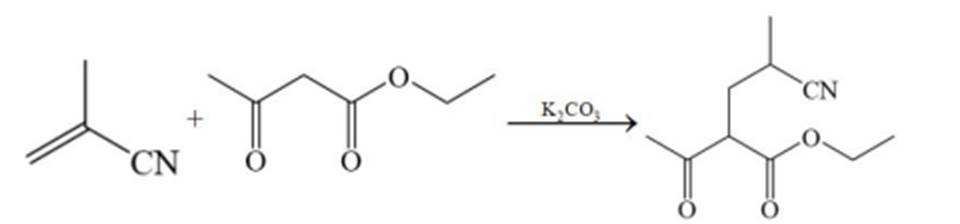
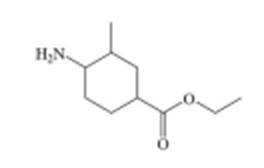
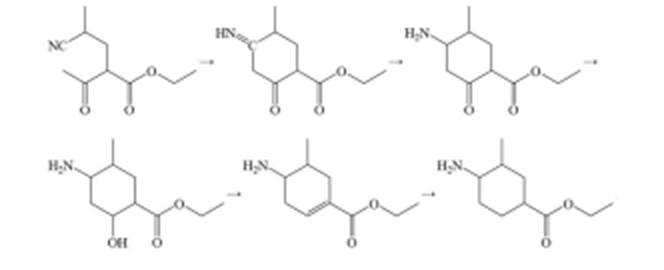
某研究小组按以下路线对内酰胺F的合成进行了探索:
回答下列问题:
(1)从实验安全角度考虑,A→B中应连有吸收装置,吸收剂为___________。
(2)C的名称为___________,它在酸溶液中用甲醇处理,可得到制备___________(填标号)的原料。
a.涤纶 b.尼龙 c.维纶 d.有机玻璃
(3)下列反应中不属于加成反应的有___________(填标号)。
a.A→B b.B→C c.E→F
(4)写出C→D的化学方程式______________________。
(5)已知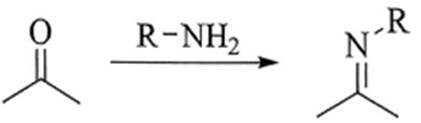
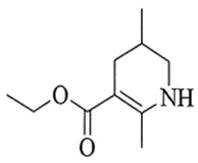
(6)已知亚胺易被还原。D→E中,催化加氢需在酸性条件下进行的原因是______________________,若催化加氢时,不加入酸,则生成分子式为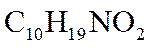
正确答案
(1)碱石灰或碱性干燥剂
(2)①甲基丙烯腈 ②d
(3)bc
(4)
(5)G 的结构比亚胺更加稳定
(6)①氰基与氢气发生加成反应生成亚胺结构生成的亚胺结构更易被还原成氨基,促进反应的 发生
②
解析
(2) 该物质可以与甲醇在酸性溶液中发生反应生成甲基丙烯酸,甲基丙烯酸经聚合反应生成有 机玻璃。其他选项的化学本质分别为:a 聚丙烯酸乙二醇酯,b 聚酰胺,c 聚乙烯醇缩甲醛
(3)发生的都是消去反应
(5)
羰基与氨基发生反应生成亚胺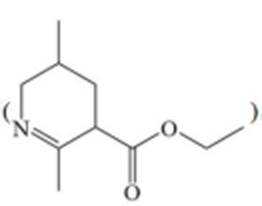
(6)氰基与氢气发生加成反应生成亚胺结构生成的亚胺结构更易被还原成氨基,促进反应的发生; 若不加入酸,则生成分子式为 C10H19NO2 的化合物 H,其可能的流程为: