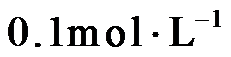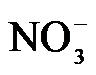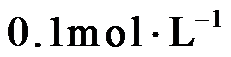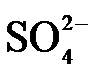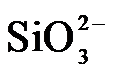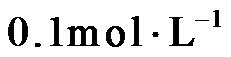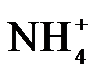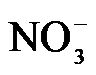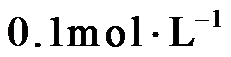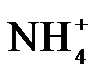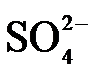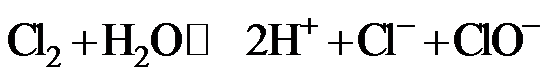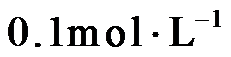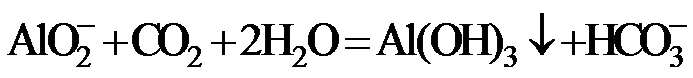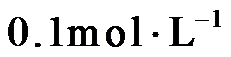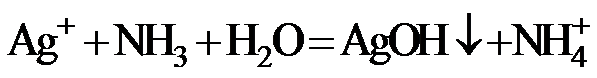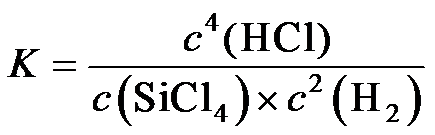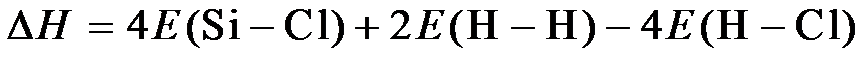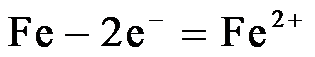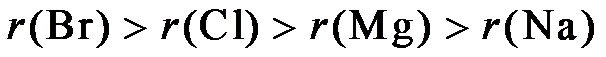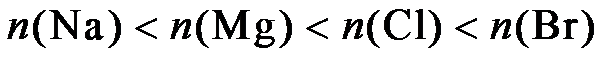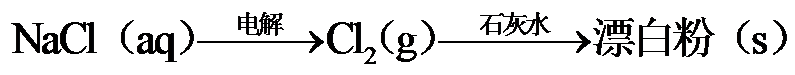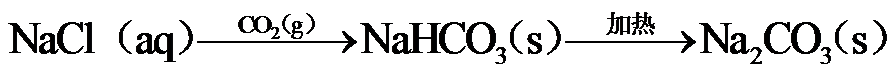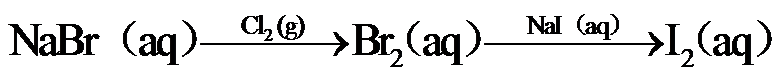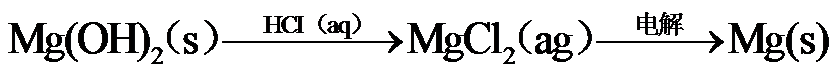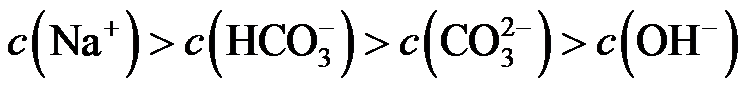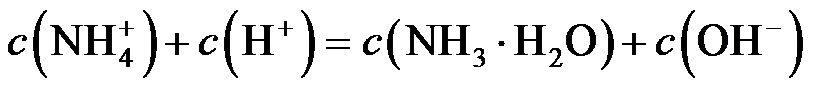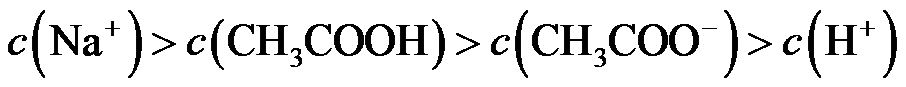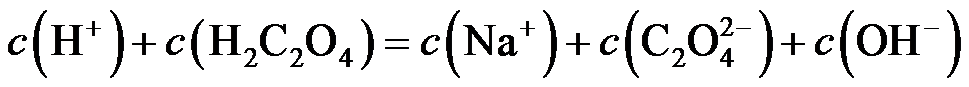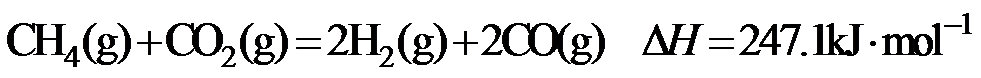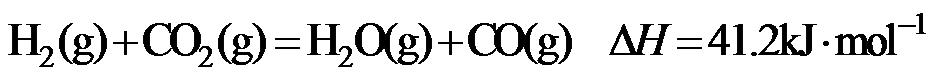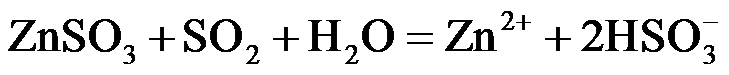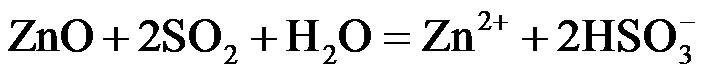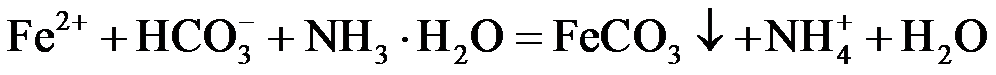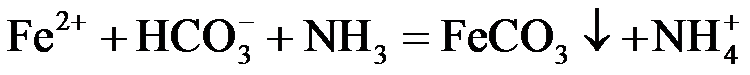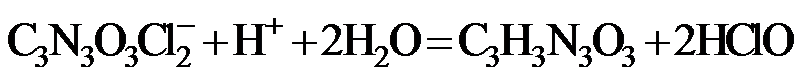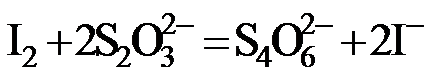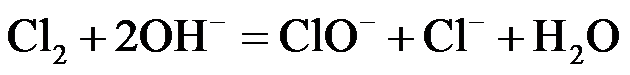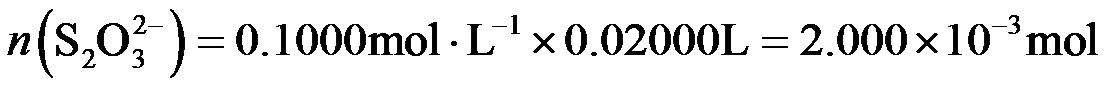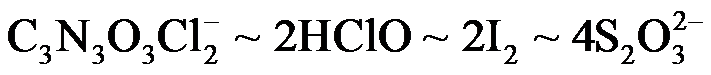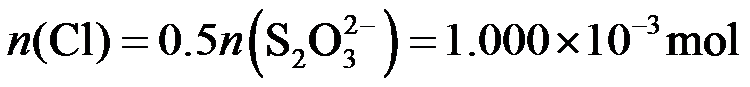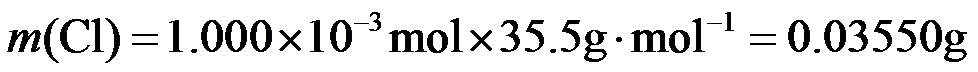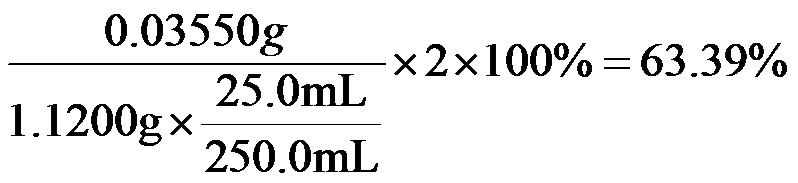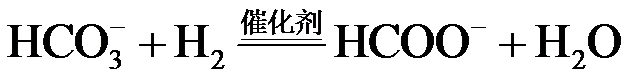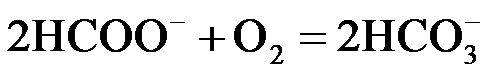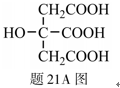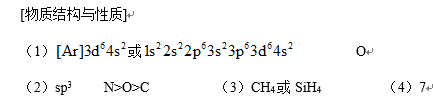- 真题试卷
- 模拟试卷
- 预测试卷
1.打赢蓝天保卫战,提高空气质量。下列物质不属于空气污染物的是
正确答案
3.下列有关物质的性质与用途具有对应关系的是
正确答案
4.常温下,下列各组离子在指定溶液中能大量共存的是
正确答案
7.下列指定反应的离子方程式正确的是
正确答案
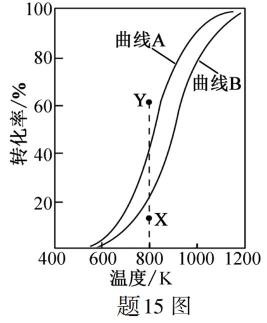
8.反应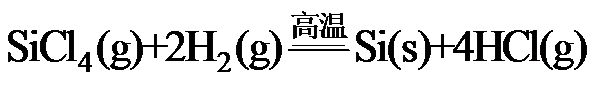
正确答案
2.反应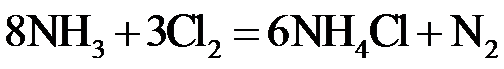
正确答案
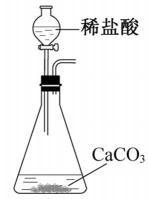
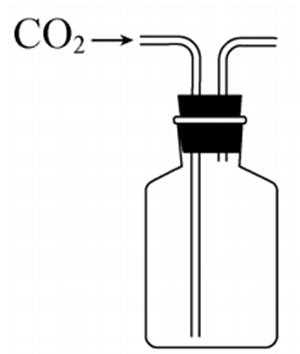
5.实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是
正确答案
6.下列有关化学反应的叙述正确的是
正确答案
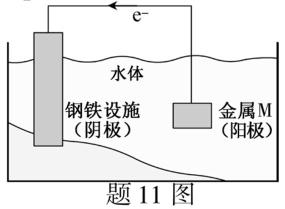
11.将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题11图所示的情境中,下列有关说法正确的是
正确答案
13.根据下列实验操作和现象所得到的结论正确的是
正确答案
阅读下列资料,完成9~10题
海水晒盐后精制得到NaCl,氯碱工业电解饱和NaCl溶液得到Cl2和NaOH,以NaCl、NH3、CO2等为原料可得到 NaHCO3;向海水晒盐得到的卤水中通Cl2可制溴;从海水中还能提取镁。
9.下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
10.下列选项所示的物质间转化均能实现的是
正确答案
正确答案
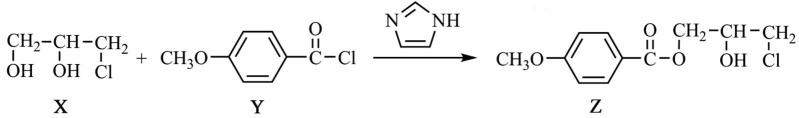
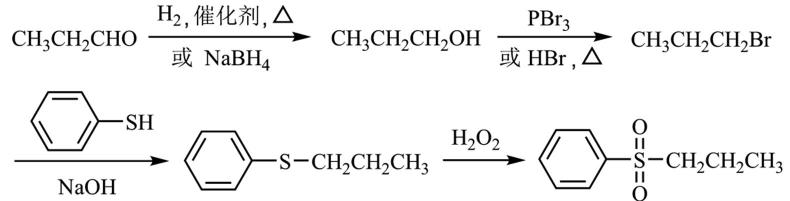
12.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
下列有关化合物X、Y和Z的说法正确的是
正确答案
14.室温下,将两种浓度均为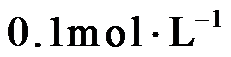
正确答案
15.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比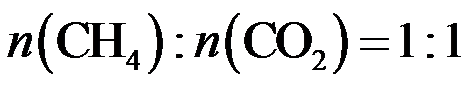
正确答案
非选择题
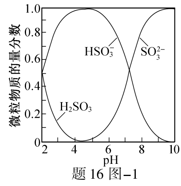
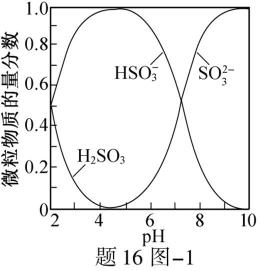
16.(12分)吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中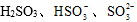
(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为 ▲ ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 ▲ (填化学式)。
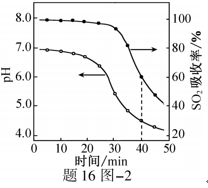
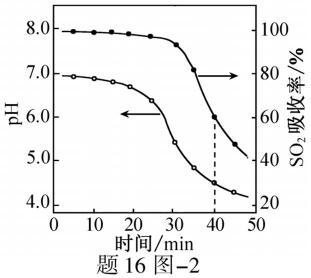
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见题16图−2)。溶液pH几乎不变阶段,要产物是 ▲ (填化学式); SO2吸收率迅速降低阶段,主要反应的离子方程式为 ▲ 。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低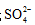
16.(12分)吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、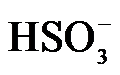
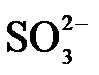
(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为 ▲ ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 ▲ (填化学式)。
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见题16图−2)。溶液pH几乎不变阶段,要产物是 ▲ (填化学式); SO2吸收率迅速降低阶段,主要反应的离子方程式为 ▲ 。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低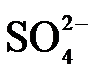
正确答案
(1)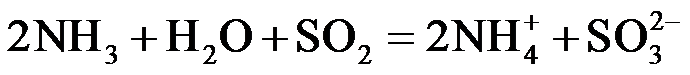
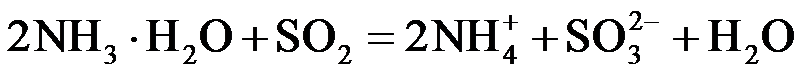
(2)ZnSO3
或
(3)随着pH降低,HSO3−浓度增大 减小
19.(15分)实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α−Fe2O3。
其主要实验流程如下:
(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 ▲ (填序号)。
正确答案
(1)AB
(2)H2 取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色
(3)pH偏低形成HF,导致溶液中F−浓度减小,CaF2沉淀不完全
(4)①
或
②在搅拌下向FeSO4溶液中缓慢加入氨水−NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
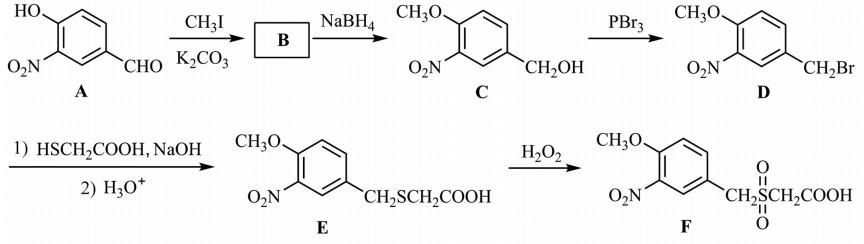
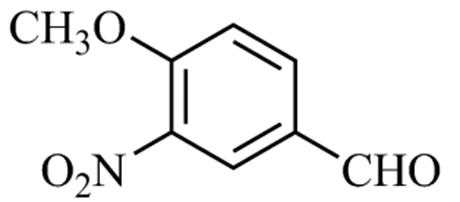
17.(15分)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如下:
(1)A中的含氧官能团名称为硝基、 ▲ 和 ▲ 。
(2)B的结构简式为 ▲ 。
(3)C→D的反应类型为 ▲ 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 ▲ 。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α−氨基酸,另一产物分子中不同化学环境的氢原子数目比为1∶1且含苯环。
(5)写出以CH3CH2CHO和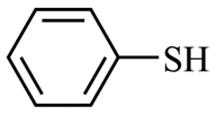
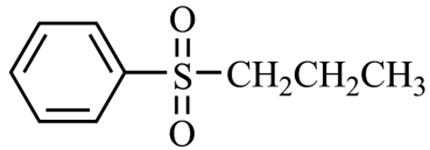
正确答案
(1)醛基 (酚)羟基
(2)
(3)取代反应
(4)
(5)
18.(12分)次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。 NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备 NaClO的离子方程式为 ▲ ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 ▲ 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
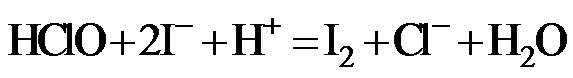
准确称取1.1200 g样品,用容量瓶配成250.0 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用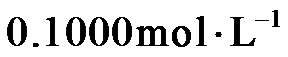
①通过计算判断该样品是否为优质品。
(写出计算过程,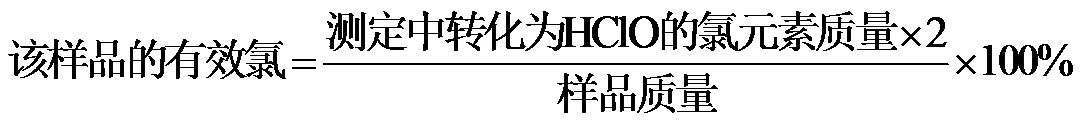
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ▲ (填“偏高”或“偏低”)
正确答案
(1)
NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解
(2)①
根据物质转换和电子得失守恒关系:
得
氯元素的质量:
该样品的有效氯为:
该样品的有效氯大于60%,故该样品为优质品
②偏低
20.(14分)CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
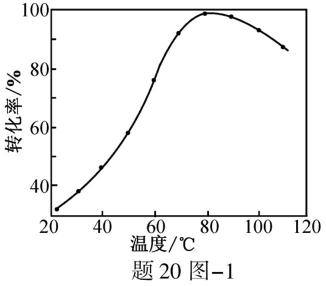
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO−,其离子方程式为 ▲ ;其他条件不变,HCO3−转化为HCOO−的转化率随温度的变化如题20图−1所示。反应温度在40℃~80℃范围内,HCO3−催化加氢的转化率迅速上升,其主要原因是 ▲ 。
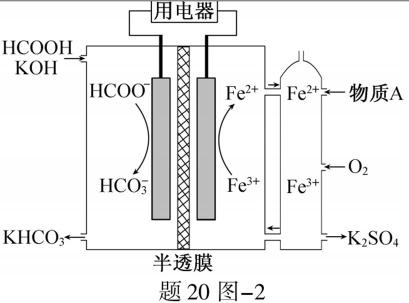
(2)HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如题20图−2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ▲ ;放电过程中需补充的物质A为 ▲ (填化学式)。
②题20图−2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 ▲ 。
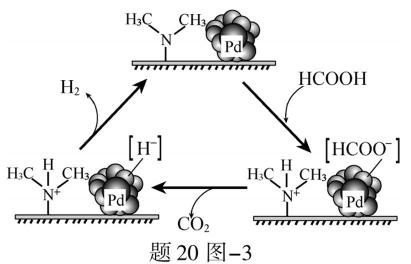
(3)HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如题20图−3所示。
② HCOOD催化释氢反应除生成CO2外,还生成 ▲ (填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是 ▲ 。
正确答案
(1)
温度升高反应速率增大,温度升高催化剂的活性增强
(2)①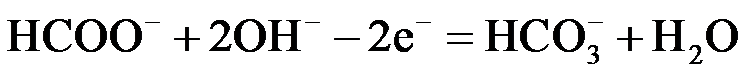
②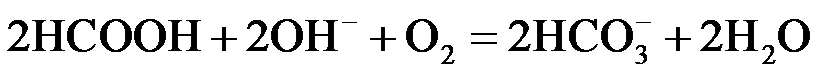
(3)①HD ②提高释放氢气的速率,提高释放出氢气的纯度
21.(12分【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
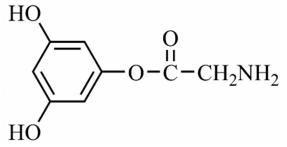
以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为 ▲ ; 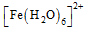
(2)NH3分子中氮原子的轨道杂化类型是 ▲ ;C、N、O元素的第一电离能由大到小的顺序为 ▲ 。
(3)与NH4+互为等电子体的一种分子为 ▲ (填化学式)。
(4)柠檬酸的结构简式见题21A图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为 ▲ mol。
[实验化学]
羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为
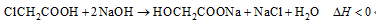
实验步骤如下:
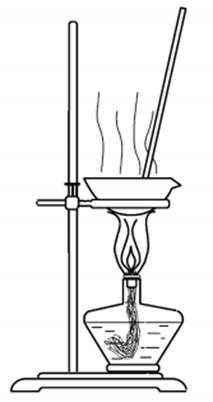
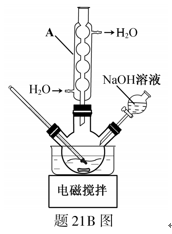
步骤1:在题21B图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
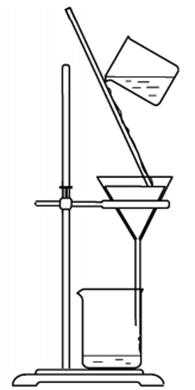
(1)步骤1中,题21B图所示的装置中仪器A的名称是 ▲ ;逐步加入NaOH溶液的目的是 ▲ 。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是 ▲ 。
(3)步骤3中,粗产品溶解于过量水会导致产率 ▲ (填“增大”或“减小”);去除活性炭的操作名称是 ▲ 。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是 ▲ 。
正确答案
正确答案
[实验化学]
(1)(回流)冷凝管 防止升温太快、控制反应体系pH
(2)防止暴沸 (3)减小 趁热过滤 (4)提高羟基乙酸钠的析出量(产率)