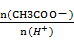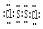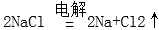- 真题试卷
- 模拟试卷
- 预测试卷
1.科研、生产和生活中的下列做法,利用了氧化还原反应的是 ( )
正确答案
解析
A选项乙醚属于有机溶剂能够溶解青蒿素,不属于化学反应;
B选项2Fe3++Cu=2Fe2++Cu2+属氧化还原反应(有化合价变化);
C选项属于物理变化(利用活性炭的吸附性);
D选项纯碱(Na2CO3)溶液水解显碱性,能促进油脂的水解生成甘油和高级脂肪酸钠,水解反应不属于氧化还原反应。
考查方向
解题思路
①.乙醚、乙醇等有机物是常见的萃取剂。
②. Fe3+能与Cu发生氧化还原反应。
③.活性炭净化空气是利用其吸附性。
④.纯碱溶液水解显碱性,促进油脂水解。
易错点
忽略Fe3+氧化性。
知识点
3.下列实验操作,对实验结果不会产生影响的是( )
正确答案
解析
A选项若用湿润PH试纸测酸性溶液值会偏大,测碱性溶液PH会偏小,测中性溶液PH则不变(常温始终为7),如:Na2SO4,故A正确;
B选项中和热实验的测定关键在防止热量散失,故操作快些,若将碱缓慢倒入酸中,会有部分热量散失,有影响,B错;
C选项中和滴定实验酸碱指示剂一般滴2-3滴(20滴≈1ml),故2-3ml指示剂会影响终点判断,C错;
D选项淀粉水解生成葡萄糖,可用银氨溶液检验,但须在碱性条件下进行,淀粉水解溶液显酸性,未加过量碱调制碱性,故D错。
考查方向
解题思路
①一般不用湿润PH试纸溶液PH,但也有特殊情况。
②中和热测定实验关键在防止热量散失,操作慢会有很多热量散失。
③中和滴定实验指示剂一般滴2-3滴。
④银镜反应须在碱性条件下进行。
易错点
对高中常见实验操作不熟练。
知识点
4.化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:
有关上述曲线图的说法正确的是( )
正确答案
解析
A选项由图象可知,V正减小,V逆增大,故不可能是由于改变温度引起,改变温度正逆反应速率将同时增大或减小,故A错;
B选项纵坐标为PH值,横坐标为所加NaOH溶液体积,滴加过程中酸碱中和,PH值逐渐增大,接近终点时溶液由酸性变中性然后碱性(PH表现为突变),故B正确;
C选项明矾溶液为KAl(SO4)2溶液,滴加Ba(OH)2过程先产生Al(OH)3和BaSO4两种沉淀,随后只有Al(OH)3溶于过量的碱,故C图错;
D选项大多数固体的溶解度随温度升高而增大,少部分除外,如:Ca(OH)2,故D错
考查方向
解题思路
①改变温度可逆反应正逆反应速率同时增大或减小。
②酸中滴碱,溶液的PH值逐渐增大,快接近滴定终点时PH值会突变。
③明矾溶液中滴加Ba(OH)2除了产生Al(OH)3沉淀还有BaSO4沉淀,后者不会溶于过量的碱。
④大多数固体的溶解度随温度升高而增大,少部分除外,如:Ca(OH)2。
易错点
不分析图中横纵坐标含义及特殊的点和曲线的变化趋势所代表的含义就盲目解答。
知识点
2. 下列有关实验的描述不正确的是( )
正确答案
解析
A选项钠与氯气发生反应生成氯化钠,为白色固体,火焰呈黄色,颜色不同,故A正确;
B选项氯水中含有次氯酸,分解生成氧气,硝酸不稳定,分解生成二氧化氮和氧气,故B正确;
C选项次氯酸和过氧化钠都具有强氧化性,可使品红褪色,原理相同,故C错误;
D选项SiO2属于酸性氧化物能用强碱NaOH反应,SiO2+2NaOH=Na2SiO3+2H2O, 故D正确。
考查方向
解题思路
①钠与氯气发生反应生成氯化钠,为白色固体,火焰呈黄色。
②氯水中含有次氯酸,分解生成氧气,硝酸不稳定,分解生成二氧化氮和氧气。
③次氯酸和过氧化钠都具有强氧化性。
④SiO2酸性氧化物能用强碱反应。
易错点
对钠和氯气及其化合物性质了解不全面。
知识点
5.下列有关说法正确的是( )
正确答案
解析
A选项加入Cu(NO3)2生产Cu形成原电池同时引入NO3-形成HNO3溶液,金属先与HNO3反应得不到H2 ,故A错;
B选项该反应正反应为放热反应,升温平衡逆向移动,故H2转化率降低,B错;
C选项根据判据ΔG=ΔH-TΔS<0反应自发进行,ΔH>0,故ΔS>0,C错;
D选项加NaCl生成白色沉淀AgCl,后加少量Na2S转化为Ag2S黑色沉淀,说明Ag2S更难溶,c(Ag+)减小,故D正确。
考查方向
解题思路
①电化学腐蚀速率大于化学腐蚀速率,金属与HNO3反应得不到氢气。
②温度升高化学平衡向吸热反应方向移动。
③当ΔG=ΔH-TΔS<0时,该反应能自发,反之则非自发。
④黑色沉淀Ag2S比白色AgCl更难溶。
易错点
不了解原电池原理的应用,不熟悉温度对化学平衡的影响,不知道反应自发性的判断依据,及沉淀之间转化原理。
知识点
6.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
正确答案
解析
A选项根据一般活泼金属作负极,故Mg为负极,石墨为正极,故A错;
B选项正极反应为:H2O2+2e-=2OH-,即双氧水得电子发生还原反应,故B错;
C选项由之前反应可知生成正极OH-,PH增大,故C正确;
D选项正极带负电吸附阳离子,Cl-带负电往负极移动,故D错。
考查方向
解题思路
①一般活泼金属作负极。
②正极得电子,发生还原反应,负极失电子,发生氧化反应。
③H2O2具有氧化性,得电子生成OH-,碱性增强。
④原电池电解质溶液中,阳离子往正极移动,阴离子往负极移动。
易错点
正负极的判断,溶液中阴阳离子移动方向。
知识点
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
25.一般情况下,当温度升高时,Ka ________(填“增大”、“减小”或“不变”).
26.下列四种离子结合
a. CO32-
b. ClO-
c. CH3COO-
d. HCO3-
27.下列反应不能发生的是________(填序号)
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
28.用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填序号);
a.
b.
c.
d.
29.体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
则HX的电离平衡常数________(填“大于”、“等于”或“小于”,下同)

30.25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中
c(CH3COO-)-c(Na+)=________ mol·L-1(填精确数值)。
正确答案
增大
解析
Ka只跟温度有关,电离过程吸热,温度升高Ka增大。
考查方向
解题思路
Ka代表弱酸电离常数,只跟温度有关,电离过程吸热,利用勒夏特列原理分析即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
a>b>d>c
解析
酸性越弱,对应的酸根离子结合质子(H+)能力越强,因为酸性:CH3COOH> H2CO3> HClO > HCO3-,所以CO32->ClO->HCO3->CH3COO-,即a>b>d>c。
考查方向
解题思路
质子即为H+,结合H+越容易,说明得到的对应的酸越弱,Ka会越小,结合表中Ka值即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
c d
解析
根据强酸制弱酸原理,
反应a:酸性CH3COOH> H2CO3 ,符合;
反应b:酸性CH3COOH> HClO ,符合;
反应c:酸性HClO > H2CO3 ,不符合;
反应d:酸性HCO3-> HClO ,不符合;(因为HClO > HCO3- 故产物不是CO32-而是HCO3-)
考查方向
解题思路
Ka越大,酸性越强,即CH3COOH> H2CO3> HClO > HCO3-,再结合强酸制弱酸原理去分析a、b、c、d四个反应即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
b
解析
CH3COOH溶液中存在两个电离平衡:CH3COOH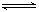



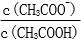
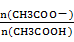
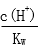
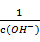
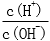
考查方向
解题思路
CH3COOH溶液中存在两个电离平衡:CH3COOH

易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
大于;大于; 稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱
解析
由图可知:稀释前:PH(HX)= PH(CH3COOH)=2,稀释100后: PH(CH3COOH)< PH(HX)<4,说明HX存在电离平衡即为弱酸,但酸性比CH3COOH强,故HX电离平衡常数大于醋酸的电离平衡常数;由于HX自身电离出的H+大于醋酸电离出的H+,根据C(H+)越大对水的电离平衡越抑制,导致水电离的H+浓度越小,故HX溶液中水电离出来的c(H+)小于醋酸溶液中水电离出来的c(H+)。
考查方向
解题思路
由图可知未稀释前PH相同,稀释相同倍数后HX的PH变化大于CH3COOH,说明酸性:HX>CH3COOH,另外这一过程溶液由10ml稀释到1000ml即稀释了100倍,稀释前后HX的PH变化小于2,说明HX是弱酸。其他的根据电离平衡影响因素分析即可。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
9.9×10-7 moL·L-1
解析
混合溶液pH=6,说明c(H+)=10-6mol/l,c(OH-)=10-8mol/l,根据电荷守恒:
c(H+)+c(Na+)=c(CH3COO-)+ c(OH-)可得:c(CH3COO-)-c(Na+)=c(H+) -c(OH-)=10-6-10-8mol·L-1=9.9×10-7 moL·L-1
考查方向
解题思路
根据溶液中阴阳离子电荷守恒分析即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
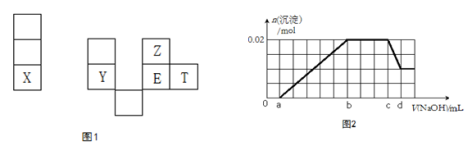
X、Y、Z、E、T均为短周期元素,在周期表中的相对位置如图1。X是短周期中原子半径最大的元素; X、Y在同一周期,Y是常见的半导体材料; E的最高价氧化物对应水化物有强脱水性。
根据判断出的元素回答问题:
7. T在元素周期表中的位置________________;
8.这几种元素的氢化物中,水溶液酸性最强的是__________ (填化学式); YZ2 的熔点__________EZ2 的熔点(填高于或低于);
9.E2T2 的电子式__________;
10.工业上制备单质X的化学反应方程式____________________;
11.已知
12.某溶液中可能含有以下阳离子(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Al3+,现取100mL该溶液逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如上图2所示。
①在实验中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为____________________;
②NaOH溶液的浓度为__________mol·L-1 (用字母c、d表示);
③原溶液中含有的Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为__________。
正确答案
3ⅦA
解析
依题意X为短周期中半径最大的元素可知,据元素周期律X为第三周期元素Na;据Y在第三周期且为半导体材料,Y为Si;浓硫酸具有脱水性,故E为S,与E相邻元素Z为O,T为Cl;故:
S元素原子结构示意图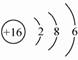
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
HCl;高于
解析
氢化物分别为:NaH、SiH4、H2O、H2S、HCl,只有H2S、HCl水溶液显酸性,前者为弱酸,后者为强酸,故酸性最强者为HCl。另外SiO2为原子晶体,SO2为分子晶体,熔点:原子晶体>分子晶体,即熔点:SiO2>SO2。
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
解析
根据S最外层6个电子(需共用2对电子),Cl最外层7个电子(需共用1对电子),故S2Cl2电子式为:
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
解析
工业一般采用电解熔融NaCl制取钠:2NaCl2Na+Cl2↑
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
Si(s)+O2(g)═SiO2(s) ΔH=-989.2 kJ·mol―1
解析
Si(s)+O2(g)═SiO2(s) ΔH=-989.2 kJ·mol―1(注意物质的状态,ΔH的正负号及数值与系数统一)
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
正确答案
①Fe3+;
② NH4+ + OH-= NH3·H2O;10/(d-c) mol·L-1
③1:1:1
解析
①由图2可知oa段未产生沉淀,说明原溶液中有H+,再据ab段产生沉淀,cd段之后沉淀未完全消失,说明ab段生成了2种沉淀,故含Mg2+和Al3+( 生成了氢氧化镁和氢氧化铝沉淀,cd段溶解了氢氧化铝),另bc段沉淀不增加也不减少,说明还含NH4+( bc段离子反应:NH4++OH_=NH3.H2O);由图2纵坐标可知Al(OH)3和Mg(OH)2两者沉淀之和为0.02mol(其中当沉淀Al(OH)3溶解后还剩下沉淀Mg(OH)20.01mol),说明Al(OH)3为0.01mol,因为cd段反应:Al(OH)3+NaOH=NaAlO2+2H2O,故n(NaOH)=0.01mol,C (NaOH)= 10/(d-c) mol·L-1。
②结合①分析并由图2信息V(NaOH)oa = V(NaOH)cd可知,n(Mg2+)= n(Al3+)= n(H+)=0.01mol,即n(Mg2+):n(Al3+):n(H+)=1:1:1。
考查方向
解题思路
熟记周期表中前20号元素,通过元素周期律和常见元素及其化合物的特性推导出各个元素。
易错点
电子式书写,溶沸点比较,热化学方程式书写要点。
化合物E是一种医药中间体,常用于制备抗凝血药,合
13.A的结构简式为____________________; B中含有的含氧官能团名称为__________;
14.C转化为D的反应类型是__________反
15.写出D与足量NaOH溶液完全反应的化学方程式
______________________________。
16.1molE最多可与__________molH2加成。
17.写出同时满足下列条件的B的一种同分异构体的结构简式__________;
A.能发生银镜反应
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1mol可消耗3molNaOH
18.已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。
苯甲酸苯酚酯(
合成路线流程图示例如下:
________________________________________
正确答案
解析
依题意可知A为醛类(O2将A氧化为CH3COOH),即A为CH3CHO;B中含氧官能团名称为羟基和羧基。
考查方向
解题思路
通过正向分析结合醛可以氧化为羧酸,可知A为醛类,再对比B、CH3COCl和D结构上的差异并结合酸和醇的酯化反应,推出C的结构。
易错点
流程分析,同分异构数目判断
正确答案
取代
解析
通过比较C和D的结构差异得出C转化为D反应为取代反应。
考查方向
解题思路
通过正向分析结合醛可以氧化为羧酸,可知A为醛类,再对比B、CH3COCl和D结构上的差异并结合酸和醇的酯化反应,推出C的结构。
易错点
流程分析,同分异构数目判断
正确答案
解析
根据酯类水解原理写出反应,特别注意消耗NaOH的量:
考查方向
解题思路
通过正向分析结合醛可以氧化为羧酸,可知A为醛类,再对比B、CH3COCl和D结构上的差异并结合酸和醇的酯化反应,推出C的结构。
易错点
流程分析,同分异构数目判断
正确答案
4
解析
因为1molE中左边苯环消耗3mol,右边环上碳碳双键再消耗1mol,一共4molH2(注:酯基上的双键无法与H2加成)。
考查方向
解题思路
通过正向分析结合醛可以氧化为羧酸,可知A为醛类,再对比B、CH3COCl和D结构上的差异并结合酸和醇的酯化反应,推出C的结构。
易错点
流程分析,同分异构数目判断
正确答案
解析
根据要求可知,该B的同分异构体结构中含一个酚羟基和一个甲酸苯酚酯类的结构,因为等效氢只有4种,说明两个取代基处于苯环的对位,即:
考查方向
解题思路
通过正向分析结合醛可以氧化为羧酸,可知A为醛类,再对比B、CH3COCl和D结构上的差异并结合酸和醇的酯化反应,推出C的结构。
易错点
流程分析,同分异构数目判断
正确答案
解析
利用逆向分析的方法,要生成该酯类物质


考查方向
解题思路
通过正向分析结合醛可以氧化为羧酸,可知A为醛类,再对比B、CH3COCl和D结构上的差异并结合酸和醇的酯化反应,推出C的结构。
易错点
流程分析,同分异构数目判断
亚硝酸钠(NaNO2)是重要的防腐剂。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图1所示(部分夹持装置略)。
已知:
①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
19.写出浓硝酸与木炭反应的化学方程式________________;
20.B中观察到的主要现象是_____________, D装置的作用是_____________;
21.检验C中产物有亚硝酸钠的方法是________________;
23.将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g 。
24.反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理,电化学降解NO3-的原理如上图2所示。25℃时,反应进行10min,溶液的pH由7变为12 。
电源正极为________(填A或B),阴极反应式为________________。
正确答案
C+4HNO3(浓) 
解析
装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓) CO2↑+4NO2↑+2H2O;
考查方向
解题思路
装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,依据氧化还原反应电子守恒和原子守恒配平;
易错点
实验目的和原理不清晰、电解原理模糊
正确答案
铜片逐渐溶解,溶液变为蓝色,有无色气体产生;吸收未反应的NO
解析
装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,故答案为:溶液变蓝,铜片溶解,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
考查方向
解题思路
装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
易错点
实验目的和原理不清晰、电解原理模糊
正确答案
取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色
解析
检验亚硝酸钠的实验设计为将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O,或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,反应的离子方程式是5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,故答案为:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠;
解题思路
依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
易错点
实验目的和原理不清晰、电解原理模糊
正确答案
0.24g
解析
整个过程发生四个反应,分别为:
①C+4HNO3(浓) 
②3NO2 + H2O == 2HNO3+NO(反应①中产生的NO2与B中水反应生成HNO3和第一部分NO)
③3Cu+8HNO3(浓) 
④2NO+Na2O2 ==2NaNO2(此处NO来自②和③总共生成)
利用①、②、③并结合N原子守恒和关系式法得出C与NaNO2 的关系式为:
3C~12NO2~4NO~8HNO3~2NO
NO来自两部分,再结合反应④得:
3C~6NO~3Na2O2 简化后:C~Na2O2
NaNO2的物质的量:n(Na2O2)=1.56/78=0.02mol
C的质量:m(C)=12×0.02=0.24g
考查方向
解题思路
先将整个过程发生的4个反应写出,多步反应利用关系式法找出C与NaNO2的关系,然后计算得出所需C的质量。
易错点
实验目的和原理不清晰、电解原理模糊
正确答案
A 2NO3- +6H2O +10e-=N2↑+1
解析
分析化合价变化可知,NO3-转化为N2化合价降低,即右边Ag-Pt电极为阴极,B为负极,A为正极。
阴极电极反应:2NO3- +6H2O +10e-=N2↑+1
考查方向
解题思路
根据电解原理,阳极阴离子失电子,化合价升高,阴极得电子,化合价降低,NO3-转化为N2化合价降低,即图2中右边Ag-Pt电极为阴极,B为负极,A为正极。
易错点
实验目的和原理不清晰、电解原理模糊