- 真题试卷
- 模拟试卷
- 预测试卷
中国书画是世界艺术瑰宝,古人所用文房四宝制作过程中发生氧化还原反应的是( )
正确答案
解析
此题主要考查了氧化还原反应的概念。需要理解什么是氧化还原反应,以及能判断一个反应过程中是否有元素化合价的升降。
A选项竹管、动物尾豪制作湖笔的过程主要是物理变化,没有涉及氧化还原反应,A错误。
B选项松木燃烧生成油烟的过程中,碳元素的化合价发生了变化,属于氧化还原反应,B正确。
C选项楮树皮制成纸浆纤维再到宣纸,主要是物理变化和化学变化,但不是氧化还原反应,C错误。
删除D选项端石加工成端砚主要是物理变化,D错误。
化学品在食品工业中也有重要应用,下列说法错误的是( )
正确答案
解析
此题主要考查了一些常见化学品在食品工业中的用途,涉及到物质的性质与用途的关系,包括活性炭的吸附性、铁粉的还原性、谷氨酸钠的调味作用以及对不能用作食品干燥剂的物质的判断等知识点。
题干分析,活性炭具有吸附性,能吸附色素和异味,可用作食品脱色剂,A正确;铁粉能与氧气反应,可消耗氧气,用作食品脱氧剂,B正确;谷氨酸钠是味精的主要成分,可用作食品增味剂,选项C正确;五氧化二磷遇水生成磷酸,有腐蚀性,不能用作食品干燥剂,D错误。
下列化学用语或图示正确的是( )
正确答案
解析
此题主要考查了有机物的命名、分子的球棍模型、原子的轨道表示式以及化学键形成的轨道重叠等知识点。
A选项对于有机物的命名,要选择包含官能团的最长碳链为主链,从靠近官能团的一端开始编号,该物质中羟基直接连在苯环上,属于酚类,甲基在羟基的邻位,所以命名为2-甲基苯酚,故A正确。
B选项臭氧分子的球棍模型应该是三个氧原子呈折线形排列,而不是直线形,B错误。
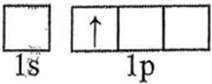
C选项激发态的氢原子轨道表示式应该是1s上有一个电子,而不是1p上有电子,C错误。
D选项P~Pπ键是由两个p轨道“肩并肩”重叠形成的,而不是图示的这种重叠方式,D错误。
下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
正确答案
解析
这道题主要考查了共价晶体的相关知识点,包括不同共价晶体的结构以及对熔点的影响等。
A选项金刚石(C)中只存在碳碳共价键,键能较大,熔点较高。
B选项单晶硅(Si)中只存在硅硅共价键,键能相对较小,熔点相对低。
C选项金刚砂(SiC)中存在碳硅共价键,键能介于碳碳键和硅硅键之间。
D选项氮化硼(BN,立方相)中存在氮硼共价键,键能较大,熔点较高。综合比较,硅硅键的键能最小,故单晶硅(Si)的熔点最低。故本题答案为:B。
物质性质决定用途,下列两者对应关系错误的是( )
正确答案
解析
此题主要考查了物质的性质与用途的关系,涉及到氢氧化钙的碱性、铁离子的氧化性、硫酸钙的性质以及氨的配位性等知识点。
A选项石灰乳主要成分是氢氧化钙
B选项氯化铁溶液中的铁离子具有氧化性,能将铜氧化,体现了铁离子的氧化性,B正确。
C选项制作豆腐时添加石膏,是利用了硫酸钙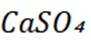
D选项氨水中的氨分子能与银离子形成配位键,从而配制银氨溶液,体现了氨的配位性,D正确。
故本题答案为:C。
下列图示实验中,操作规范的是( )
正确答案
解析
此题主要考查了化学实验基本操作的相关知识点,包括滴定操作的规范、用 pH 试纸测定溶液 pH 的方法、加热试管中液体的注意事项以及向试管中滴加溶液的正确操作等。
A选项调控滴定速度时,操作应规范,A正确。
B选项用pH试纸测定溶液时,不能将pH试纸直接伸入溶液中,B错误。
C选项加热试管中的液体时,液体体积不能超过试管容积的三分之一,C错误。
D选项向试管中滴加溶液时,滴管应垂直悬空在试管口上方,不能伸入试管内,D错误。
故本题答案为:A。
我国科学家在青蒿素研究方面为人类健康作出了巨大贡献。在青蒿素研究实验中,下列叙述错误的是( )
正确答案
解析
此题主要考查了对物质研究方法及所涉及知识点的理解。包括萃取法的应用、X 射线衍射对晶体结构的测定、核磁共振谱对分子结构的分析以及红外光谱对官能团的推测等知识点。
萃取是利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法,青蒿素可以用萃取法获得提取液,A正确。
X射线衍射可以用于测定晶体结构,B正确。
核磁共振谱主要用于确定有机物分子中氢原子的种类和相对数目等,不能推测相对分子质量,C错误。
红外光谱可用于确定有机物分子中含有的官能团,D正确。
植物提取物阿魏萜宁具有抗菌活性,其结构简式如图所示。下列关于阿魏萜宁的说法错误的是( )
正确答案
解析
此题主要考查了有机物的结构与性质相关的知识点,包括有机物与某些物质的反应、消去反应的产物、水解产物的性质以及发生的反应类型等。
A选项该物质含有酚羟基,能与
B选项该物质含有羟基,且与羟基相连的碳的邻位碳上有氢原子,可发生消去反应,消去反应产物最多有3种,B错误。
C选项酸性条件下水解产物中含有酚羟基和羧基的物质可发生缩聚反应生成高聚物,C正确。
D选项该物质含有碳碳双键可发生加成反应,含有苯环可发生取代反应,D正确。
故本题答案为:B。
由O,F,I组成化学式为
正确答案
解析
此题主要考查了对物质结构的理解,包括原子的表示、化学键的类型、孤对电子以及键长等知识点。
A选项由图可知,图中较大的原子应为碘原子(Ⅰ),较小的原子为氟原子(F)和氧原子(0),A错误。
B选项从图中不能看出存在过氧键,B错误。
C选项碘原子(Ⅰ)周围有未成键的电子对,即存在孤对电子,C正确。
D选项化合物中不同的碘氧键所处环境不同,键长不一定相等,D错误。
故本题答案为:C。
常温下



正确答案
解析
此题主要考查了化学平衡、电离平衡以及平衡常数等知识点
A选项随着pH增大,氢离子浓度减小,醋酸的电离平衡正向移动,醋酸根离子浓度增大,所以线1表示

B选项当



C选项





D选项



故本题答案为:BC。
中国美食享誉世界,东坡诗句“芽姜紫醋炙银鱼”描述了古人烹饪时对食醋的妙用。食醋风味形成的关键是发酵,包括淀粉水解、发酵制醇和发酵制酸等三个阶段。下列说法错误的是( )
正确答案
解析
此题主要考查了淀粉的水解、发酵过程中的物质变化以及反应条件等知识点。涉及到对化学反应过程和产物的理解与判断。
A选项淀粉水解会生成葡萄糖,A正确。
B选项发酵制醇阶段,酵母菌无氧呼吸会产生二氧化碳,B正确。
C选项发酵制酸阶段不一定会产生酯类物质,C错误。
D选项发酵制醇阶段需要无氧条件,但发酵制酸阶段有的微生物可能需要有氧条件,D错误。
故本题答案为:CD。
由下列事实或现象能得出相应结论的是( )
正确答案
解析
此题主要考查了氧化还原反应、原电池原理、沉淀溶解平衡以及化学反应速率与化学平衡等知识点
A选项酸性高锰酸钾具有强氧化性,草酸能使酸性高锰酸钾溶液褪色,说明草酸具有还原性,故A正确。
B选项铅蓄电池在放电过程中,负极铅失电子生成硫酸铅,质量增加,正极二氧化铅得电子生成硫酸铅,质量也增加,B正确。
C选项虽然


D选项将盛有
故本题答案为:AB。
以不同材料修饰的



正确答案
解析
此题主要考查电解池原理、电极的判断、电解反应方程式的书写以及相关物质的量关系等知识点
A选项要实现高效制氢气,应该在阴极产生氢气,所以电极a为阴极,应连接电源负极,A正确。
B选项从图中可以看出加入Y是为了补充
C选项电解总反应式应该是
D选项根据催化阶段的反应可知,产物Z为氢气,溴离子转化为溴酸根离子,根据得失电子守恒,反应产物物质的量之比
故本题答案为:BC。
钧瓷是宋代五大名瓷之一,其中红色钩瓷的发色剂为


正确答案
解析
此题主要考查了氧化亚铜的性质、硝酸的氧化性、配合物以及两性氧化物的概念等知识点
A选项氧化亚铜

B选项试管甲中沉淀转化为硝酸铜,体现了硝酸的氧化性,但沉淀消失是硝酸的酸性,B错误。
C选项试管乙中沉淀溶解,溶液颜色变为深蓝色,说明生成了铜氨配合物,可证明Cu(I)与氨形成无色配合物,C正确。
D选项两性氧化物是既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,这里只体现了与酸和碱的反应,但不能明确就是两性氧化物,D错误。
故本题答案为:AC。
逆水气变换反应:
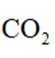
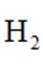





正确答案
解析
此题主要考查了化学反应速率、化学平衡以及影响它们的因素等知识点,包括温度对反应速率常数的影响、平衡状态的判断、速率方程的应用等。
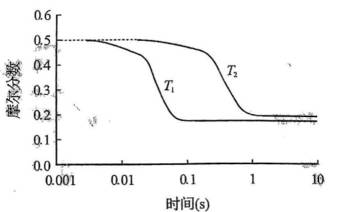
A选项该反应正反应吸热,温度升高,反应速率加快,从图像看,相同时间内,


B选项达平衡时,反应速率与温度和浓度有关,
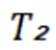
C选项温度不变,仅改变体系初始压力,平衡不移动,但反应速率会改变,所以反应物摩尔分数随时间的变化曲线会改变,C错误
D选项温度下改变初始投料比例,若按化学计量系数之比投料,可使平衡时各组分摩尔分数与
故本题答案为:CD。
(12分)锰氧化物具有较大应用价值,回答下列问题:
(1)
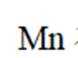
(2)

当

删除A.


(3)
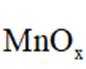




(4)
正确答案
(1)四 VⅡB
(2)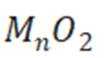
(3)正四面体形
(4)形成更多分子间氢键
解析
此题主要考查了元素周期表的相关知识,包括元素在周期表中的位置、未成对电子数的比较;催化剂的相关知识,还考查了晶胞的相关知识,以及物质的性质与结构的关系,涉及到熔点等物理性质与分子结构等方面的知识点。
(1)Mn的原子序数为25,电子排布式为1s22s22p63s23p63d54s2,所以Mn在元素周期表中位于第四周期ⅦB族。同周期中,从左到右未成对电子数增多,第四周期中未成对电子数比Mn(有5个未成对电子)多的元素有Cr(有6个未成对电子)。
故本问答案为:四;ⅦBCr。
(2)由图可知,晶胞中Mn位于顶点、面心和体心,顶点Mn被8个晶胞共用,面心Mn被2个晶胞共用,体心Mn为1个晶胞独有,所以晶胞中Mn的个数为:


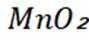
当晶体有0原子脱出时,出现0空位,为了保持化合物的电中性,Mn的化合价会降低。CaO中 删除Ca为+2价,0为-2价,CaO晶体难以通过这种方式获得半导体性质;

故本问答案为:
(3)

咪唑环中N原子形成了大π键,说明N原子采用
故本问答案为:正四面体;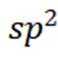
(4)题干中提到了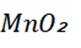
删除FDCA能形成大量分子间氢键,HMF不能形成分子间氢键。
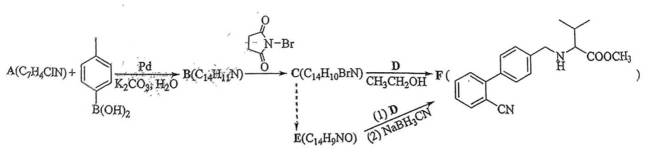
(12分)心血管药物缬沙坦中间体(F)的两条合成路线如下:
已知:
I.
II.
回答下列问题:
(1)A结构简式为_________;B→C反应类型为__________________。
(2)C+D→F化学方程式为___________________________。
(3)E中含氧官能团名称为__________________;F中手性碳原子有_________个。
(4)D的一种同分异构体含硝基和3种不同化学环境的氢原子(个数此为6:6:1),其结构简式为__________________。
(5)C→E的合成路线设计如下:
试剂X为__________________(填化学式);试剂Y不能选用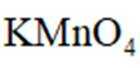
正确答案
(3)醛基 1
(4)
(5)

解析
此题主要考查了有机物的结构简式、反应类型的判断、化学方程式的书写、官能团的名称、同分异构体的书写、有机合成路线中试剂的选择以及手性碳原子等知识点
(1)根据已知信息及反应流程可推出
删除A的结构简式为
(2)C为

(3)E中含氧官能团名称为醛基;F中手性碳原子有1个。
(4)D的一种同分异构体含硝基和3种不同化学环境的氢原子(个数比为6:6:1),其结构简式为
(5)第一步:由C到B的转化可知,试剂为NaOH;
第二步:试剂Y不能选用酸性高锰酸钾,原因是会氧化苯环上的甲基,无法得到E。
(12分)以铅精矿(含

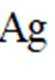
回答下列问题:
(1)“热浸”时,难溶的






(2)将“过滤Ⅱ”得到的

(3)“还原”中加入铅精矿的目的是__________________。
(4)“置换”中可选用的试剂X为_________(填标号)
删除A.


“置换”反应的离子方程式为__________________。
(5)“电解II”中将富银铅泥制成电极板,用作_________(填“阴极”或“阳极”)。
正确答案
(1)1:1
(2)热浸
(3)将

(4)C
(5)阴极
解析
此题主要考查了化学反应原理、物质的转化、化学方程式的书写及计算、电解原理等知识点。涉及到难溶物的溶解平衡转化、物质的氧化性与还原性、离子反应等相关知识
(1)
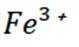



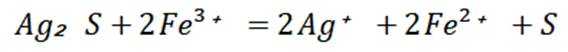

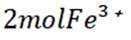
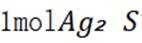



(2)将“过滤Ⅱ”得到的
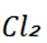
(3)“还原”中加入铅精矿的目的是将

(4)“置换”中要将银置换出来,可选用比银活泼的金属,且不产生杂质,只有Pb,所以选C。
则“置换”反应的离子方程式为
(5)“电解Ⅱ”中将富银铅泥制成电极板,要得到银,将富银铅泥制成阳极,Pb失电子生成
(12分)利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
实验过程如下:
①加样,将




②燃烧:按一定流速通入
③滴定:当F内溶液浅蓝色消退时(发生反应: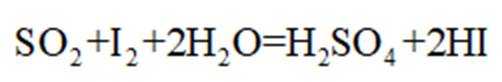
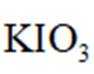

回答下列问题:
(1)取

删除A.玻璃棒 B.1000mL锥形瓶 C.500mL容量瓶 D.胶头滴管
(2)装置B和C的作用是充分干燥
(3)该滴定实验达终点的现象是__________________;滴定消耗

(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进

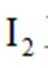


正确答案
(1)AD
(2)浓硫酸 防止发生倒吸
(3)滴入最后半滴标准液溶液,溶液原色变浅蓝色且半分钟内不褪色
(4)催化剂 加热导致
解析
这道题主要考查了以下知识点:
溶液配制所需仪器的选择。
气体干燥试剂的选择以及实验装置中特殊部件的作用。
滴定实验终点现象的判断和有关计算。
实验误差的分析,包括实验条件改变对产物生成的影响,以及操作不当对测定结果的影响,涉及氧化还原反应的原理和化学计量关系。
(1)配制1000mL碱性标准溶液,需要用到的仪器有玻璃棒、1000mL容量瓶、胶头滴管,所以选AD。
(2)B中的试剂为浓硫酸,用于干燥氧气。磨砂浮子密度小于水,水面上升时,会将导气管的出气口堵塞上,从而防止倒吸。
(3)滴定实验达终点的现象是:当最后一滴标准液滴入时,溶液由无色变为浅蓝色,且半分钟内不褪色。
根据化学方程式

得关系式:

则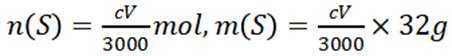

粉尘在该过程中的作用是催化剂。若装置E冷却气体不充分,部分

(12分)水煤气是
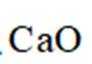


回答列问题:
(1)

(2)压力p下,







(3)压力p下、温度为


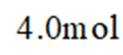





正确答案
(1)
(2)
(3)
(4)不变 不变
解析
此题主要考查了化学反应热的计算、化学平衡移动原理、平衡常数的计算等知识点
(1)将反应Ⅰ加上反应Ⅱ再加上反应Ⅲ可得:
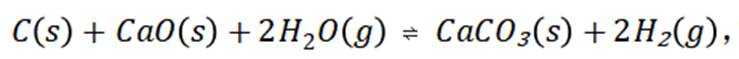
(2)第一步:在给定的反应体系中,C(s)己完全反应,






第二步:当温度高于



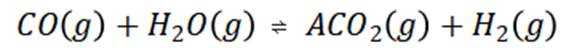
(3)第一步:设起始时

第二步:反应
因为




即生成了
若向平衡体系中通入少量