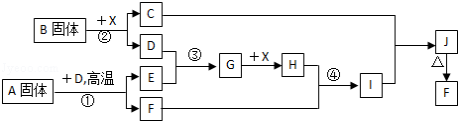- 真题试卷
- 模拟试卷
- 预测试卷
5.可逆反应:2NO2⇌2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时,生成2n mol NO;
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列有关二氧化硫的说法中,错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.能正确表示下列化学反应的离子方程式是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应.所得溶液中Fe2+能被标准状况下112mL氯气氧化.则原混合物中金属元素和氧元素的原子个数之比为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.设NA为阿伏加德罗常数,下列叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应.则X为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲可能结构有( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子质量)为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.用惰性电极进行电解,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成.在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色.则原混合气体的成份是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.根据下列物质的化学性质,判断其应用错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.下列反应中,有沉淀产生且不会消失的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.若溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定可以大量共存的离子组是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.天然维生素P(结构如图)是一种营养增补剂.关于维生素P的叙述,错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%.
(1)A的化学式为___________; F的化学式为___________;
(2)反应 ③的化学方程式:___________;
(3)反应②的离子方程式:___________;
(4)反应④的离子方程式:___________;
(5)已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为:_______.
正确答案
(1)FeS2;Fe2O3;
(2)反应③是二氧化硫和氧气的反应,反应方程式为2SO2+O2
故答案为:2SO2+O2
(3)反应②是过氧化钠与水反应,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH﹣+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH﹣+O2↑;
(4)反应④是三氧化二铁和硫酸反应,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(5)已知每生成16g E为SO2,物质的量为0.25mol,放出106.5kJ热量,依据化学方程式4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g);生成8molSO2,放热为: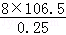
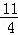
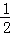
故答案为:FeS2(s)+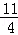
解析
解析已在路上飞奔,马上就到!
知识点
18.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
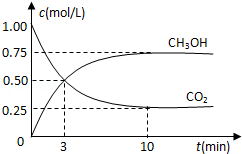
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L•min).
②该反应的平衡常数表达式为______________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要___________等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
___________
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有___________(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32﹣的方法是:___________
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体__________g
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是_______
(7)上述工艺流程中体现绿色化学理念的是:___________
正确答案
(1)CaCO3(或CaO)、NH3、H2O.
(2)CaSO4+CO32﹣=CaCO3+SO42﹣
(3)CaSO4;
(4)取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32﹣,反之则不含有CO32﹣;
(5)54;
(6)ad;
(7)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).
解析
解析已在路上飞奔,马上就到!
知识点
19.存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种.A遇FeCl3溶液发生显色反应.F分子中除了2个苯环外,还有一个六元环.它们的转化关系如下:
请回答下列问题:
(1)有机物A中含氧官能团的名称是 ______ ;
(2)写出下列反应的化学方程式
A→B:____________;
M→N:____________;
(3)A→C的反应类型为,E→F的反应类型为____________;
(4)1molA可以和_____molBr2反应;
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有_______种(不包括R);
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式.
___________________________________。
正确答案
(1)酚羟基、羧基;
(2)

CH3CH2OH
(3)加成反应,酯化反应;
(4)3;
(5)4;
(6)

解析
答案已在路上飞奔,马上就到!