- 真题试卷
- 模拟试卷
- 预测试卷
8.设NA表示阿伏加德罗常数的值。下列说法正确的是
正确答案
解析
A、溶液体积不明确;故溶液中碳酸根的个数无法计算,故A错误B、一个氢氧化铁胶粒有多个氢氧化铁胶体的聚集体;故1molFeCl3形成的氢氧化铁胶体粒子数目小于NAC、PH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L,故1L的该溶液中的氢氧根的个数为0.01 NA 个,故C错误D、1 mol苯和1mol苯甲酸完全燃烧时均消耗7.5mol氧气。故1 mol苯和苯甲酸的混合物完全燃烧时消耗氧气7.5mol,即7.5 NA 个氧气分子,与两者比例无关,故D正确本题正确答案是D
考查方向
解题思路
A、溶液体积不明确;B、一个氢氧化铁胶粒有多个氢氧化铁胶体的聚集体;C、PH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/LD、1 mol苯和1mol苯甲酸完全燃烧时均消耗7.5mol氧气。
易错点
阿伏伽德罗常数的有关计算;阿伏伽德罗定律
知识点
13.常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
正确答案
解析
A.体积图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,铵根离子与R-的水解程度相等,故A错误;B. a~b点导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故B正确;C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;D.常温下水的离子积为:KW=c(H+)×c(OH-)=1.0×10-14,由于b-c点溶液的反应温度相同,则水的离子积不变,故D正确;
本题正确答案是A
考查方向
解题思路
A.b点溶液pH=7,此时加入10mLHR,HR与一水合氨的浓度、体积相等,则二者恰好反应; B.根据图象可知,a~b点导电能力增强,说明HR为弱电解质,在溶液中部分电离,加入氨水后生成强电解质,离子浓度增大;C.c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-);D.b-c点,溶液的温度不变,则水的离子积不变.
易错点
离子浓度定性比较、溶液酸碱性与溶液pH的计算
知识点
7.化学与生产、生活、社会密切相关。下列说法中不正确的是
正确答案
解析
蛋白质、棉花、PVC、淀粉都是高分子化合物,化学式中n不同,故都使混合物,故A正确B、根据可回收利用垃圾:废弃金属、废纸、废弃玻璃、废弃塑料、废弃电池等;B正确C、铁在潮湿的空气中易形成原电池而发生电化学腐蚀,而不是直接接触的化学反应,C错误D、可降解塑料分解产生CO2 ,CO2又合成聚碳酸酯可降解塑料,实现了“碳”的循环利用
考查方向
解题思路
A、高分子化合物的相对分子质量特别大,一般1万以上,具有重复的结构单元,化学式中n不同;B、根据可回收利用垃圾:废弃金属、废纸、废弃玻璃、废弃塑料、废弃电池等;C、铁在潮湿的空气中易发生电化学腐蚀;D、可降解塑料分解产生CO2 ,CO2又合成聚碳酸酯可降解塑料,实现“碳”的循环利用
易错点
高分子化合物的分子式;金属的电化学腐蚀与防护;常见的生活环境的污染与治理。
知识点
9.我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖。已知二羟
正确答案
解析
A、二羟甲戊酸结构中含一个-COOH,与乙醇发生酯化反应生成产物中有一个酯基,其分子式为C8H16O4故A错误。B、不能发生加成反应,故B错误C、含-CH2OH在铜催化下与氧气发生反应的产物为含醛基,故能发生银镜反应,故C正确。D、1mol可生成1.5mol氢气,但状况未知,不能计算其体积,故D错误
本题正确答案是C
考查方向
解题思路
由二羟甲戊酸的结构可知,分子中含-COOH、2个-OH,结合羧酸、醇的性质来解答。
易错点
有机物官能团性质及其反应的类型
知识点
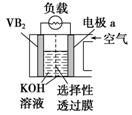
11.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为4VB2+11O2===4B2O3+2V2O5。下列说法正确的是
正确答案
解析
硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,所以X为正极,故A错误;B、原电池中,阴离子向负极移动,阳离子向正极移动,所以溶液中的OH-向另一极移动,故B错误;C、电子通过外电路由负极向正极移动,溶液中只有离子的移动。故C错误D、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O,故D正确.本题正确答案是D
考查方向
解题思路
A、根据原电池中负极失电子来判断;B、原电池溶液中阴离子向负极移动;C、电子通过外电路由负极向正极移动,D、负极上是VB2失电子发生氧化反应.
易错点
原电池的工作原理,电极反应式的判断。
知识点
12.有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多。下列说法正确的是
正确答案
解析
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.A.X两种常见氧化物有氧化钠、过氧化钠,氧化钠只含有离子键,过氧化钠含有离子键、共价键,故A错误;B.N与M形成的化合物为氯化铝,铝离子水解,溶液呈酸性,故B正确;C.电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:N(Al3+)<(Na+),Y(S2-)>(Cl-),故C错误;D.非金属性Y(S)<M(Cl),故气态氢化物的稳定性:Y<M,故D错误,故选:B.本题正确答案是B
考查方向
解题思路
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.
易错点
物质结构、核外电子排布与元素的性质的关系。
知识点
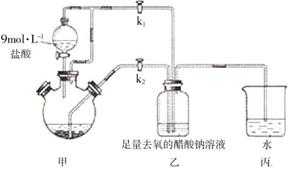
醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量。
14.三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为 。
15.实现步骤③中溶液自动转移至装置乙中的实验操作为 
16.装置丙中导管口水封的目的是 。
17.为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是 。
18.已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.4g,则该实验所得产品的产率为 (不考虑溶解的醋酸亚铬水合物)。
19.铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气,再加入碱液,调节pH至少为 才能使铬的离子沉淀完全。
【已知Cr(OH)3的溶度积为6.3×10-31 ,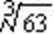
20. 一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在。
。
正确答案
Zn+2Cr3+=2Cr2++Zn2+
解析
往三颈烧瓶中依次加过量锌粒、适量CrCl3溶液,据题意可知:Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g),过量的Zn与CrCl3反应,使深绿色(Cr3+)变为亮蓝色(Cr2+),可得:2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq),故答案为:Zn+2Cr3+=2Cr2++Zn2+
考查方向
解题思路
往三颈烧瓶中依次加过量锌粒、适量CrCl3溶液,据题意可知:Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)深绿色(Cr3+)变为亮蓝色(Cr2+),可得:2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
关闭k1,打开k2。
解析
利用生成氢气,使装置内气体增大,将生成的CrCl2溶液压入装置乙中与CH3COONa溶液顺利混合。所以其操作为关闭k1,打开k2 ;故答案为:关闭k1,打开k2
考查方向
解题思路
利用生成氢气,使装置内气体增大,将生成的CrCl2溶液压入装置乙中与CH3COONa溶液顺利混合。所以其操作为关闭k1,打开k2 ;
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
防止空气进入装置乙中氧化Cr2+。
解析
醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,所以装置丙中导管口用水封,目的防止空气进入装置乙中氧化Cr2+ ;故答案:防止空气进入装置乙中氧化Cr2+
考查方向
解题思路
醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,所以装置丙中导管口用水封,目的防止空气进入装置乙中氧化Cr2+ ;
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
解析
洗涤[Cr(CH3COO)2)]2·2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,当然不能用能乙醇和盐酸了,因为醋酸亚铬水合物,是微溶于醇,易溶于盐酸。因此先用水洗去那些离子,再用乙醚来洗去多余的水。多余的乙醚可以挥发掉;故答案为:C
考查方向
解题思路
洗涤[Cr(CH3COO)2)]2·2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,当然不能用能乙醇和盐酸了,因为醋酸亚铬水合物,是微溶于醇,易溶于盐酸。因此先用水洗去那些离子,再用乙醚来洗去多余的水。多余的乙醚可以挥发掉;
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
83.3%
解析
CrCl3的物质的量为: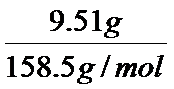
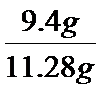
故答案为:83.3%;
考查方向
解题思路
CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2•2H2O (相对分子质量为376)的理论产量,进而计算其产率;
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
5.6
解析
向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31,此时溶液中c(OH-)=4×10-9,
所以溶液的pH=-lgc(H+)=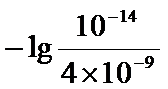
考查方向
解题思路
向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31计算溶液中c(OH-),再结合水的离子积计算c(H+),溶液pH=-lgc(H+).
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
①混合气体通入澄清石灰水,溶液变浑浊,说明混合气体中含有CO2。
②混合气体通入灼热的CuO,固体颜色由黑色变为红色,说明混合气体中含有CO。
(其他合理答案均可)
解析
[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,检验这两种气体的存在,

②检验CO气体,原理:CuO + CO 
考查方向
解题思路
[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,检验这两种气体的存在,
①检验CO2气体,原理:CO2+Ca(OH)2==CaCO3↓+ H2O;其操作混合气体通入澄清石灰水,现象:澄清石灰水变浑浊;
②检验CO气体,原理:CuO + CO
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
22.脱碳。
将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3
取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应热△H3_____0(填“>”、“<”或“=”),该反应的平衡常数表达式为_______。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示,试回答:
0~10min内,氢气的平均反应速率为_____mol/(L·min)。第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数 (填“变大”、“减少”或“不变”)。
23.脱硫。
①有学者想利用如右图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:____
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
正确答案
① < K=
解析
本题涉及化学反应中的能量变化以及化学平衡知识的综合计算知识,原电池原理分析,电解质溶液中电荷守恒的应用,化学反应速率、平衡常数计算分析,属于综合知识的考查,难度中等
考查方向
本题涉及化学反应中的能量变化以及化学平衡知识的综合计算知识,原电池原理分析,电解质溶液中电荷守恒的应用,化学反应速率、平衡常数计算分析,属于综合知识的考查,难度中等
解题思路
本题涉及化学反应中的能量变化以及化学平衡知识的综合计算知识,原电池原理分析,电解质溶液中电荷守恒的应用,化学反应速率、平衡常数计算分析,属于综合知识的考查,难度中等
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
正确答案
SO2-2e-+2H2O=SO42-+4H+ B
解析
①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO2-2e-+2 H2O=4H++SO42-;原电池放电时,电流由正极流向负极,电子带负电荷,流动方向与电流方向相反,即电子流向由A流向C,故答案为:A;SO2-2e-+2 H2O=4 H++SO42-;
②将硝酸铵溶解于水中,由于溶液中铵根离子水解显示酸性,即NH4++H2O⇌NH3•H2O+H+,其PH<7,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,利用电荷守恒c(H+)+c(NH4+)=c(NO3-)+c(OH-),c(NH4+)=c(NO3-),即增加c(NH4+)加入适量的硝酸,会使c(NO3-)增大,错误;加入适量的氨水,使溶液的 PH = 7,则NH3•H2O
考查方向
解题思路
①SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电子由负极流向正极;
②溶液中铵根离子水解显示酸性,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,根据电荷守恒来分析.
易错点
化学反应方程式的书写、产率的计算、溶度积有关计算、物质的检验等
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:
FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
24.化合物FeTiO3中铁元素的化合价是 。
25.滤渣A的成分是 。
26.滤液B中TiOCl42-转化生成TiO2的离子方程式为 。
27.反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
28.写出由滤液D生成FePO4的离子方程式 。
29.由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
正确答案
+2
解析
反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,故答案为:+2;
考查方向
解题思路
根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
SiO2
解析
由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,故答案为:SiO2;
考查方向
解题思路
MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
TiOCl42-+H2O△TiO2↓+2H++4Cl-
解析
根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
考查方向
解题思路
根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
温度过高时,反应物氨水(或双氧水)会受热分解
解析
由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
考查方向
解题思路
二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
2Fe2+ + 2H3PO4 + H2O2 
解析
根据流程图示可知,滤液D是FeCl2 溶液,加入双氧水和磷酸过滤可得沉淀FePO4,化学方程式为:2FeCl2 + 2H3PO4 + H2O2 

考查方向
解题思路
滤液D是FeCl2 溶液,加入双氧水和磷酸过滤可得沉淀FePO4,化学方程式为:2FeCl2 + 2H3PO4 + H2O2 

易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
20/9
解析
根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×17% y
34y=90×x×17%,所以x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9;
考查方向
解题思路
根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
10.下列根据实验操作和现象和所得出的结论正确的是
正确答案
B
解析
A.只能说明含有钠元素,不一定为钠盐,可能为碱溶液,故A错误; B.同类型的沉淀,溶度积小的沉淀先析出,即Ksp(AgCl)>Ksp(AgI),故B正确;C.溶液X 中滴加稀硝酸,生成硫酸根离子,滴加Ba(NO3)2溶液时生成硫酸钡白色沉淀,则溶液X中含有SO42-或SO32-,故C错误;D.葡萄糖与新制Cu(OH)2浊液反应需在碱性条件下,应加入碱将水解后的淀粉溶液调节成碱性,才可以产生砖红色沉淀,故D错误.
本题正确答案是B
考查方向
解题思路
A.只能说明含有钠元素;B.同类型的沉淀,溶度积小的沉淀先析出;C.亚硫酸根离子具有还原性,能被稀硝酸氧化为硫酸根离子;D.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应.
易错点
物质的检验、难溶电解质的溶解平衡;离子的检验方法