- 真题试卷
- 模拟试卷
- 预测试卷
3.已知钡的某种同位素是
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列试剂的保存方法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.根据有机物的命名原则,下列命名正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.若需通过导电实验证明NaCl是离子化合物,可以选择的实验对象是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列化学反应发生后,固体物质质量增加的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图。该拒食素与下列某试剂充分反应,所得有机物分子中官能团个数增加,则该试剂是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列实验装置或操作(已略去部分夹持仪器)正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.化学与日常生活密切相关,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.下列关于乙醇的说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.氢化热是指一定条件下,1 mol不饱和化合物加氢时放出的热量。表中是环己烯(

根据表中数据推断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.茶叶中铁元素的检验可经过以下四步完成,其中各步所选仪器不必要的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.已知25℃时某溶液中含有大量Na+、H+、Fe3+、HCO3-、OH-、I-中的某几种,并且由水电离出的c(H+) = 1×l0-13 mol/L。当向该溶液中滴入几滴淀粉溶液,再缓慢通入一定量的Cl2后,溶液显蓝色。下列有关分析正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.常温下,将10 mL 0.2 mol/L的一元酸HA与V mL等浓度的NaOH溶液混合。当V=10 mL时,所得溶液中部分微粒组成及浓度如图所示。假设溶液体积可以相加,则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
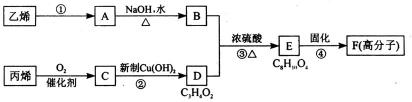
17.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如下。
关于该过程的相关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下表中对应关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.双球连通管中发生2 NO2 
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
21.室温下,用含 0.2 mol NaOH的溶液恰好吸收0.2 mol NO2后得1 L溶液,反应的化学方程式为:2 NO2 + 2 NaOH → NaNO3 + NaNO2 + H2O。对反应后的溶液,下列说法正确的是( )(已知:Ka(HNO2)= 7.1×10-4、Ka(CH3COOH)= 1.7×10-5)
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
22.已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
19.碳纳米管是近年来材料科学研究的热点。为除去碳纳米管中的杂质——碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体。以下判断正确的是( )
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
18.往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
23.元素周期表中VIIA元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素原子的电子排布式为____________。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 

完成I中反应的总化学方程式:



II中转化的基本反应类型是____________,该反应过程能析出KClO3晶体而无其它晶体析出的可能原因是___________________________________。
(4)一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。
D是____________(填微粒名称)。
B → A + C反应的热化学方程式为_________________________(用离子符号表示)。
正确答案
(1)1s22s22p5
(2)b、c
(3)1 NaCl + 3 H2O → 1 NaClO3 + 3 H2↑。
复分解反应
原因是室温下,氯酸钾在水中的溶解度明显小于其它晶体。
(4)D是高氯酸根离子(填微粒名称)。
热化学方程式为3 ClO-(aq) → ClO3-(aq) + 2 Cl—(aq) + 117 kJ(用离子符号表示)。
解析
解析已在路上飞奔,马上就到!
知识点
24.铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。这一腐蚀过程中发生还原反应的物质是________(填化学式)。图中A、B、C、D四个区域,生成铁锈最多的是____(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
步骤I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: ___________________________。
步骤II中发生反应:4 Fe(NO3)2 + O2 + (2n+4) H2O → 2 Fe2O3·nH2O + 8 HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为______________________________。
上述生产流程中,能体现“绿色化学”思想的是__________________(任写一项)。
(3)已知t℃时,反应FeO(s) + CO(g) 
写出K1的表达式____________________。
若该反应在恒容容器中反应时满足如图所示变化,则该反应的正反应为________反应(选填“吸热”或“放热”)。
若在t℃的2 L恒温密闭容器中加入0.02 mol FeO(s),并通入一定量CO。若5 min后FeO(s)转化率为50%,则CO2的平均反应速率为____________。
正确答案
(1) O2;B
(2)解释:4 HNO3 
化学方程式为4 Fe + 10 HNO3 → 4 Fe(NO3)2 + NH4NO3 + 3 H2O。
能体现“绿色化学”思想的是氮氧化物排放少(合理即可)(任写一项)。
(3)K1的表达式K1=[CO2]/[CO];正反应为吸热反应;0.001 mol/(L·min)
解析
解析已在路上飞奔,马上就到!
知识点
27.不饱和酯类化合物在药物、涂料等领域应用广泛。下列反应是一种由烯烃制备不饱和酯的新方法:
(1)化合物I的分子式为________,1 mol化合物I能与____ mol H2恰好完全反应生成饱和烃类化合物。
(2)化合物I可由芳香族化合物II或III分别通过消去反应获得,但只有II能与Na反应产生H2,II的结构简式为___________________________;由III生成I的反应条件为___________________。
(3)聚合物
正确答案
(1)C9H10;4
(2)

(3)CH2=CHCOOCH2CH3
化学反应方程式:CH2=CH2 + H2O 
2 CH2=CH2 + 2 CH3CH2OH + 2 CO + O2 
n CH2=CHCOOCH2CH3 
解析
解析已在路上飞奔,马上就到!
知识点
28.非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
请回答下列问题:
(1)非诺洛芬中的含氧官能团除了醚的结构外还有____________(填名称)。
(2)写出反应④的反应类型:________________。
(3)写结构简式:
X:_________;C:_________。
(4)非诺洛芬的一种同分异构体满足下列条件:
①能发生银镜反应
②本身不能与FeCl3溶液发生显色反应,但水解产物之一可以。
③分子中有6种不同化学环境的氢,且分子中含有两个苯环。
任写一种符合以上条件的同分异构体的结构简式:_______________。
(5)根据已有知识并结合相关信息,写出以

正确答案
(1)羧基
(2)取代反应
(3)X:
(4)



(5)
解析
解析已在路上飞奔,马上就到!
知识点
25.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为___________________________;该操作的目的是____________________。
(2)操作X应在____________(填写仪器名称)中进行,简述得到溶液B的过程:将混合溶液静置后,_______________________________。
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40˚C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________________;锥形瓶里盛放的溶液为____________(填溶质的化学式)。
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I-或IO3-。可以使用________(填溶质的化学式,下同)溶液检验可能存在的I—或________溶液检验可能存在的IO3-。
在检验该含碘废水中是否含有I-或IO3—前必需要进行的操作是__________(填序号)。
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液
正确答案
(1)离子方程式为SO32-+ I2 + H2O → 2 I-+ SO42-+ 2 H+;该操作的目的是使CCl4中的碘进入水层
(2)分液漏斗(填写仪器名称)中进行;将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体。待下部液体完全分离后,关闭活塞,从上部倒出剩余液体。
(3)原因是使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化);溶液为NaOH溶液。
(4)试剂FeCl3(合理即可,下同)或试剂Na2SO3;a、c。
解析
解析已在路上飞奔,马上就到!
知识点
26.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3 + SO2 → Na2S2O5
(1)装置I中产生气体的化学方程式为______________________________。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是________。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是_____(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是______________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:
(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O → H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g/L。
在上述实验过程中,若有部分HI被空气氧化,则测得结果________(填“偏高”、“偏低”或“不变”)。
正确答案
(1)Na2SO3 + H2SO4 → Na2SO4 + SO2↑+ H2O或Na2SO3 + 2 H2SO4 → 2 NaHSO4 + SO2↑+ H2O。
(2)分离方法是过滤。
(3)d
(4)a、e
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成。
(6)0.16 g/L;偏低
解析
解析已在路上飞奔,马上就到!
知识点
29.已知:4 NH3 + 5 O2 
(1)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气________ mol。
②为使NH3恰好完全氧化为NO,氨—空气混合气体中氨的体积分数(用小数表示)为________(保留2位小数)。
(2)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的总转化率。
(3)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
正确答案
(1)①0.75a ;②0.14
(2)97.5%
(3)
解析
解析已在路上飞奔,马上就到!