- 真题试卷
- 模拟试卷
- 预测试卷
7.中华民族有着光辉灿烂的发明创造史,下列古代的技术应用中不涉及化学反应的是( )
正确答案
解析
A. 制陶瓷的原料是粘土,发生化学变化生成硅酸盐产品;
B. 湿法炼铜,由由CuSO4·5H2O→Cu,有新物质生成,属于化学反应;
C. 海水晒盐,没有新物质生成,不涉及化学反应。
D. 粮食酿酒,有新物质酒精生成,涉及化学反应。
考查方向
解题思路
没有新物质生成,不涉及化学反应;有新物质生成,涉及化学反应。
易错点
烧结粘土制陶瓷
知识点
9.分子式为C4H10O的醇与分子式为C6H12O2的羧酸形成的酯(不考虑立体异构)共有( )
正确答案
解析
分子式为C4H10O,能发生酯化反应,即属于醇类,此类有机化合物的同分异构体,有4种,即:根据分子式为C6H12O2的酸的种类取决于﹣C5H11的种类,﹣C5H11的异构体有8种:﹣CH2CH2CH2CH2CH3、﹣CH(CH3)CH2CH2CH3、﹣CH(CH2CH3)2、﹣CHCH(CH3)CH2CH3、﹣C(CH3)2CH2CH3、﹣C(CH3)CH(CH3)2、﹣CH2CH2CH(CH3)2、﹣CH2C(CH3)3,有8种,所以分子式为C4H10O的醇与分子式为C6H12O2的羧酸形成的酯共有:4×8=32种,故选B.
考查方向
解题思路
分子式为C4H10O的有机物,能发生酯化反应的有机物物质是醇类,同分异构体有4种;根据分子式为C6H12O2的酸的种类取决于﹣C5H11的种类,据此确定二者形成的酯的种类.
易错点
本题考查了同分异构体数目的计算,题目难度中等,明确“C5H10O2的酸的种类取决于﹣C4H9的种类”为解答关键,注意掌握同分异构体的书写原则。
知识点
12.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y和W的原子序数之和是Z的3倍,下列说法正确的是( )
正确答案
解析
短周期元素X、Y、Z、W,W原子的最外层电子数是最内层电子数的3倍,若为2个电子层,则W的最外层电子数为6,所以W为O,由位置可知,不符合题意;若为3个电子层,则W的最外层电子数为6,所以W为S,由位置可知,X为N,Y为Al,Z为Si,
A.电子层越多,半径越大,当具有相同电子层时,原子的原子序数越大其原子半径越小,则X、Y、Z、W的原子半径大小为:Y>Z>W>X;
B.气态氢化物的稳定性: Z
C.非金属性W>Z,则最简单气态氢化物的热稳定性为W>Z,;
D.最高价氧化物对应水化物的酸性:Y
考查方向
解题思路
短周期元素X、Y、Z、W,W原子的最外层电子数是最内层电子数的3倍,若为2个电子层,则W的最外层电子数为6,所以W为O,由位置可知,不符合题意;若为3个电子层,则W的最外层电子数为6,所以W为S,由位置可知,X为N,Y为Al,Z为Si
知识点
8.NA为阿伏伽德罗常数的值。下列说法正确的是( )
正确答案
解析
A、H218O与D2O的相对分子质量均为20,且所含有中子数均为10个;
B、每个乙烯分子中有2对共用电子对,1.4g乙烯中应含有0.1NA个共用电子对;
C、Fe3O4看成Fe2O3·FeO,3mol单质Fe完全转变为Fe3O4,失去8nA个电子;
D、浓盐酸反应变稀且具有挥发性,实际反应的盐酸小于0.6mol,故转移的电子数小于0.3NA。
考查方向
解题思路
A、H218O与D2O的相对分子质量均为20;
B、每个乙烯分子中有2对共用电子对;
C、Fe3O4看成Fe2O3·FeO;
D、浓盐酸反应变稀且具有挥发性。
易错点
1. Fe3O4看成Fe2O3·FeO
2. 每个乙烯分子中有2对共用电子对;
知识点
11.一种熔融碳酸盐燃料电池工作原理如图所示。则下列推断错误的是( )
正确答案
解析
A.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2,有二氧化碳生成,故A正确;
B.正极为氧气得电子生成CO32﹣,反应为O2+2CO2+4e﹣=2CO32﹣,故B正确;
C.反应CH4+H2O
D.熔融碳酸盐为电解质,应在高温下进行工作,常温下不能形成原电池,故D错误。故选D。
考查方向
解题思路
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32﹣,以此解答该题。
易错点
化学电源新型电池,易错点点在明确原电池中物质得失电子、电子流向、离子流向,难点是电极反应式书写,要根据电解质确定正负极产物。
知识点
13.室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
正确答案
解析
A项,处于a点时,酸不足, c (H + )< c(OH - ), c(HA) < c(A-);
B项,在点b时,pH=4.7,酸过量c (H + )>c(OH - ),依据物料守恒判定 c(Na+) = c(A-)+c(HA);
C项,当V(HA)=10.00ml时,两者完全反应,此时由于A - 的水解,溶液呈碱性, =C(OH-)< 1.0×10-7mol·L-1;
D项,在滴定过程中,b点所示溶液中,酸过量c (H + )>c(OH - ),则有c(Na+) > c(A-) > c(H+) > c(HA)。
考查方向
解题思路
A项,处于a点时,酸不足;
B项,在点b时,pH=4.7,酸过量;
C项,当V(HA)=10.00ml时,两者完全反应;
D项,在滴定过程中,b点所示溶液中,酸过量。
易错点
据图分析各点的酸碱过量情况。
知识点
按如右图所示装置进行铁和水蒸气反应的实验。
18.铁粉与水蒸气反应的化学方程式是: ;
19.为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能验证气体产物的实验现象 ;
20.停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法: ;
21.经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用离子方程式说明): ;
22.某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置:通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-===H2↑
正确答案
Fe+4H2O(g) Fe3O4+4H2
解析
铁粉与水蒸气反应生成四氧化三铁和氢气。
考查方向
本题主要考查了铁与水蒸气反应实验探究、铁离子检验、氢氧化亚铁制备以及电化学的应用。
解题思路
在高温下,铁粉和水蒸气反应,产物有四氧化三铁和氢气。
正确答案
a—f—g—b—c—h或a—f—g—c—b—h。黑色的氧化铜变成红色,白色的无水CuSO4变成蓝色
解析
用A盛放铁粉,用B制取水蒸气,铁和水蒸气反应后有部分水蒸气剩余,所以a出来的气体通过浓硫酸进行干燥,洗气瓶中的导气管应该是长进短出,所以a连接f,f连接g,干燥后的氢气进入C装置,可以从b进入,也可以从c进入,所以g可以连接b或c,氧化铜和氢气反应有水蒸气生成,水能使无水硫酸铜变蓝,所以c或b连接h,因此其排序为:afgbch 或afgcbh,当看到无水硫酸铜变蓝,黑色的氧化铜变成红色,则生成的气体是氢气。
考查方向
解题思路
生成的气体产物为氢气,氢气与氧化铜反应生成水,氢气与氧化铜反应之前要干燥,根据氧化铜、无水硫酸铜颜色变化可以验证;
易错点
装置的连接顺序一般是发生装置→除杂→干燥→性质实验→尾气处理
正确答案
滴加KSCN溶液,溶液变红色
解析
Fe3+的检验用KSCN,即滴加KSCN溶液,溶液变红色
考查方向
本题主要考查了铁与水蒸气反应实验探究、铁离子检验、氢氧化亚铁制备以及电化学的应用。
解题思路
检验滤液中是否含有Fe3+的简单方法是滴入几滴KSCN溶液,观察溶液是否变红色;
正确答案
2Fe3++Fe=2Fe2+
解析
固体产物含有四氧化三铁和未反应的铁,四氧化三铁和铁都与盐酸反应生成盐,而且铁与铁离子反应生成Fe2+导致滤液中检验不出Fe3+
考查方向
解题思路
反应生成四氧化三铁可以与稀硫酸发生反应Fe3O4+8H+=Fe2++2Fe3++4H2O,若铁粉过量,还可以和铁离子反应生成亚铁离子,所以滤液中可能含有铁离子,也可能不含有铁离子;
正确答案
①4Fe(OH)2+O2+2H2O═4Fe(OH)
②ABD
解析
①Fe(OH)2被空气中的氧气氧化为氢氧化铁
②欲溶液中产生大量的白色沉淀,且较长时间不变色,即利用生成的氢气从上到下排除溶液中的氧气,即B端是阴极,b是负极,阴极材料可以是铁也可以是其它能导电的材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀,金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+。因此选ABD。
考查方向
本题主要考查了铁与水蒸气反应实验探究、铁离子检验、氢氧化亚铁制备以及电化学的应用。
解题思路
①氢氧化亚铁不稳定接触空气时很快被氧化为氢氧化铁;
②要较长时间观察到氢氧化亚铁的白色沉淀,关键是怎样降低反应体系中氧气的量,利用生成的氢气赶净装置中的氧气,氢气应在B电极产生;
易错点
欲溶液中产生大量的白色沉淀,且较长时间不变色,即利用生成的氢气从上到下排除溶液中的氧气。
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
25.溴的价电子排布式为 ;PCl3的空间构型为 。
26.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A. CsICl2 = CsCl+ICl
B. CsICl2 = CsI+Cl2
27.根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
28.下列分子既不存在s-p

29.已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为 ,写出CO的等电子体的微粒 (写出1个)。
30.钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知该氧化物的密度是
正确答案
4s24p5 三角锥
解析
光气(COCl2)各原子最外层都满足8电子稳定结构,光气分子的结构式是
考查方向
解题思路
光气(COCl2)各原子最外层都满足8电子稳定结构;溴有4个电子层,最外层有7个电子。
易错点
本题考查了晶体结构、原子杂化方式的判断和等电子体的含义,易错点根据价层电子对互斥理论即可解答原子杂化方式。
正确答案
A
解析
离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,晶格能CsCl>CsI所以发生的反应为CsICl2=CsCl+ICl,
考查方向
本题主要考查了晶体结构、原子杂化方式、晶格能 。
解题思路
离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,
易错点
本题考查了晶体结构、原子杂化方式的判断和等电子体的含义,易错点根据价层电子对互斥理论即可解答原子杂化方式。
正确答案
碘
解析
元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,
考查方向
解题思路
HCl、HF中只存在存在s-p


易错点
本题考查了晶体结构、原子杂化方式的判断和等电子体的含义,易错点根据价层电子对互斥理论即可解答原子杂化方式。
正确答案
解析
HCl、HF中只存在存在s-p


考查方向
解题思路
HCl、HF中只存在存在s-p


易错点
本题考查了晶体结构、原子杂化方式的判断和等电子体的含义,易错点根据价层电子对互斥理论即可解答原子杂化方式。
正确答案
sp2杂化 N2 或CN-
解析
ClO2-中心氯原子的价层电子对个数n=(7+1)/2=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与CN-互为等电子体的分子为N2 或 CO;
考查方向
解题思路
ClO2-中心氯原子的价层电子对个数n=(7+1)/2=4;等电子体具有相同的电子数目和原子数目的微粒;
易错点
本题考查了晶体结构、原子杂化方式的判断和等电子体的含义,易错点根据价层电子对互斥理论即可解答原子杂化方式。
正确答案
CaO2
解析
钙在氧气中燃烧时得到一种钙的氧化物晶体,根据其结构钙离子与过氧根离子个数比为1:1,化学式为CaO2晶胞的质量为


考查方向
解题思路
钙在氧气中燃烧时得到一种钙的氧化物晶体,根据其结构钙离子与过氧根离子个数比为1:1,根据密度公式得到晶胞体积。
易错点
本题考查了晶体结构、原子杂化方式的判断和等电子体的含义,易错点根据价层电子对互斥理论即可解答原子杂化方式。
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
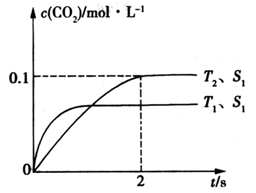
23.汽车尾气净化的主要原理为2NO(g)+2CO(g)
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
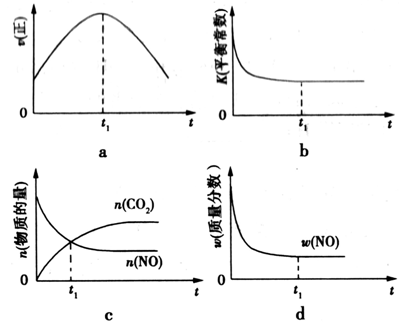
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。
24.直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
2NO2(g)=N2O4(g) △H=-56.9kJ·mol-1
写出CH4(g)催化还原N2O4(g)的热化学方程式:
___________________________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。
③常温下0. 1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=______________mol·L-1(填写最终计算结果)。
正确答案
①<
②0.025
③bd
解析
③a.反应达到平衡状态时,各物质的反应速率不再变化,故错误。
b.该反应在绝热、恒容的密闭体系中进行,相当于升高温度,当温度不变时,化学平衡常数不变,故正确。
c.二氧化碳和一氧化氮的物质的量相等时,该反应不一定达到平衡状态,故错误。
d.反应达到平衡状态时,各物质的质量分数不再发生变化,故正确。
考查方向
解题思路
(1)T1>T2,先拐先平温度高,温度越高,二氧化碳浓度越低,所以该反应是△H<0。具图分析先拐先平,定一议二。
(2)②+①得到CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1,据此计算反应的焓变;电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(3)电离常数K=
正确答案
①CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1
②CO2+2H++2e-=HCOOH ③10-7
解析
①将第一个方程式减第二个方程式得:
CH4(g)+N2O4(g)
②催化剂b表面上二氧化碳得电子和氢离子反应生成甲酸,所以发生的电极反应式为:
CO2+2H++2e-
考查方向
解题思路
(1)T1>T2,先拐先平温度高,温度越高,二氧化碳浓度越低,所以该反应是△H<0。具图分析先拐先平,定一议二。
(2)②+①得到CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1,据此计算反应的焓变;电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(3)电离常数K=
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
正确答案
A
解析
A.溶液下层呈紫红色,说明有碘单质生成,还原剂的还原性大于还原产物,说明I﹣还原性强于Cl﹣;
B.白色沉淀为硫酸钡,Al(OH)3溶于强碱;
C.淀粉在酸性条件下水解生成葡萄糖,检验时应在碱性条件下进行反应,题中没有调节溶液至碱性;
D.溶解度大的难溶物能转化为溶解度小的难溶物,AgCl白色悬浊液中加入Na2S溶液,白色沉淀变为黑色,所以说明Ksp(Ag2S)<Ksp(AgCl).故选A.
考查方向
解题思路
A.还原剂的还原性大于还原产物;
B.白色沉淀为硫酸钡;
C.水解后应在碱性条件下发生反应;
D.溶解度大的难溶物能转化为溶解度小的难溶物。
易错点
本题考查化学实验方案评价,易错点涉及还原性比较、离子检验以及沉淀转化等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答。