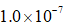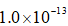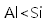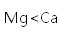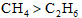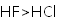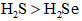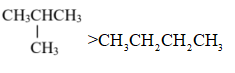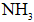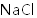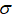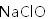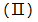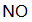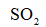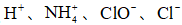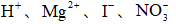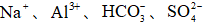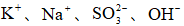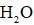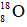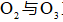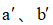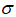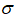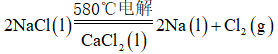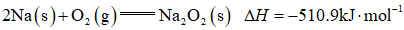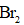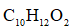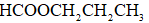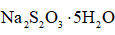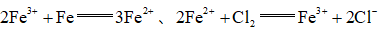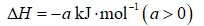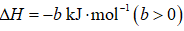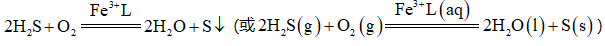- 真题试卷
- 模拟试卷
- 预测试卷
年我国在科技领域不断取得新成就。对相关成就所涉及的化学知识理解错误的是( )
正确答案
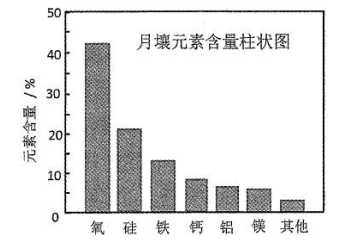
嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是( )
正确答案
下列物质沸点的比较,正确的是( )
正确答案
利用反应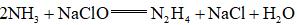
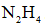
正确答案
燃油汽车行驶中会产生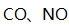
正确答案
向恒温恒容密闭容器中通入2mol 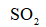
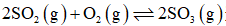
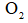
正确答案
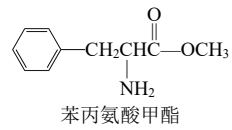
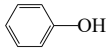
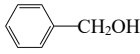
下列关于苯丙氨酸甲酯的叙述,正确的是( )
正确答案
25℃时,下列各组离子中可以在水溶液中大量共存的是( )
正确答案
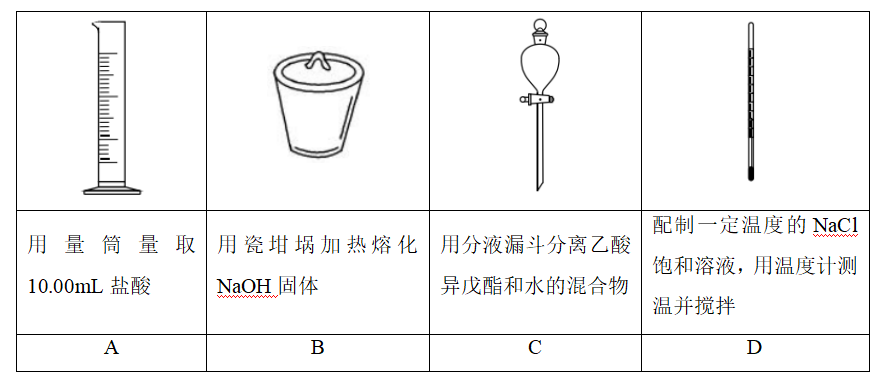
下列实验操作中选用仪器正确的是( )
正确答案
下列叙述错误的是( )
正确答案
实验装置如图所示。接通电源后,用碳棒(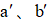
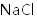
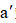
正确答案
一定条件下,石墨转化为金刚石吸收能量。下列关于石墨和金刚石的说法正确的是( )
正确答案
金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为______。
(2)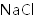
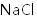
加入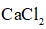
(3)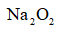
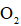
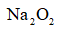
(4)采用空气和Na为原料可直接制备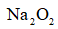
a.浓硫酸 b.饱和食盐水 c.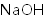
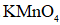
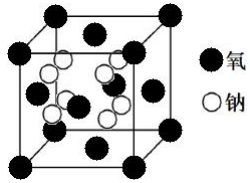
(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为______。
(6)天然碱的主要成分为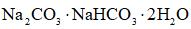
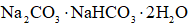
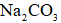
正确答案
(1)
(2)作助熔剂,降低
(3)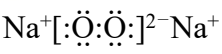
(4)c ;a
(5)
(6)159
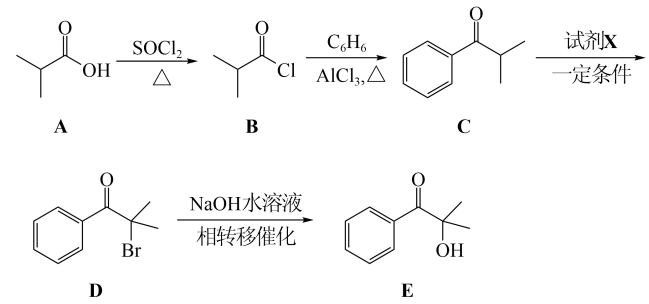
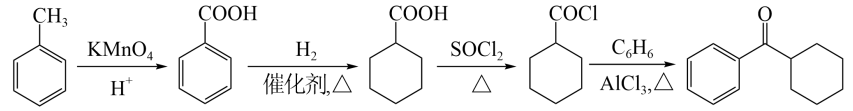
光固化是高效、环保、节能的材料表面处理技术。化合物E是一种广泛应用于光固化产品的光引发剂,可采用异丁酸(A)为原料,按如图路线合成:
回答下列问题:
(1)写出化合物E的分子式:______,其含氧官能团名称为______。
(2)用系统命名法对A命名:______;在异丁酸的同分异构体中,属于酯类的化合物数目为______,写出其中含有4种处于不同化学环境氢原子的异构体的结构简式:______。
(3)为实现C→D的转化,试剂X为______(填序号)。
a.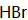
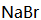
(4)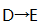
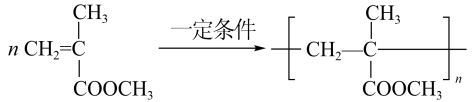
(5)在紫外光照射下,少量化合物E能引发甲基丙烯酸甲酯(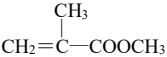
(6)已知: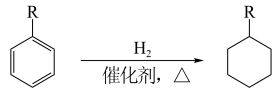
参照以上合成路线和条件,利用甲苯和苯及必要的无机试剂,在方框中完成制备化合物F的合成路线。
正确答案
(1)

(2)2-甲基丙酸;4;
(3)c
(4)取代反应(或水解反应)
(5)
(6)
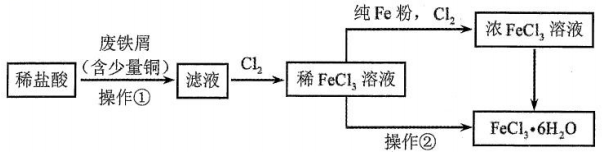
氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ.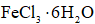
制备流程图如下:
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为______。含有少量铜的废铁屑比纯铁屑反应快,原因为______。
(2)操作①所必需的玻璃仪器中,除烧杯外还有______。
(3)检验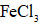
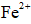
(4)为增大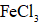
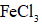
(5)操作②为______。
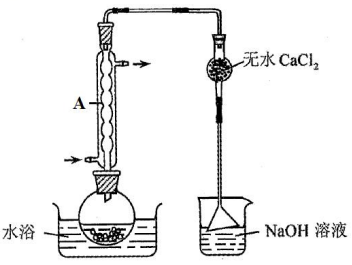
Ⅱ.由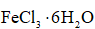
将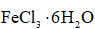
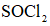
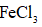
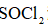
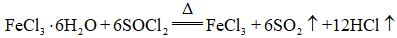
(6)仪器A的名称为______,其作用为______。
(7)干燥管中无水
(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是______(填序号)。
a.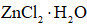
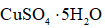
正确答案
(1)不再有气泡产生;Fe、Cu在稀盐酸中形成原电池,加快反应速率
(2)漏斗、玻璃棒
(3)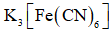
(4)
(5)在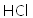
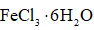
(6)球形冷凝管(1分);冷凝回流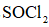
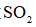
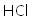
(7)碱石灰与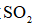
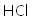
(8)a
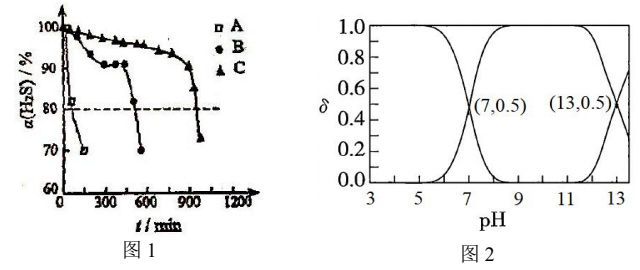
天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物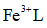
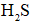
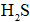
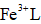
①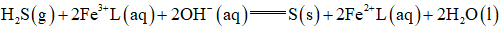
②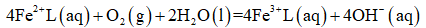
回答下列问题:
(1)该工艺的总反应方程式为______。1mol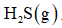
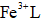
(2)研究不同配体与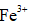
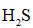
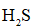
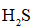

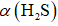
(3)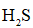
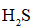
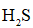

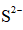
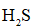
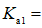
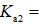
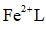
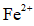
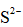
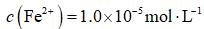
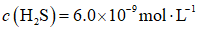
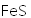
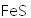
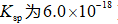
正确答案
(1)
放出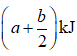
(2)A
(3)